
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кристаллы с водородными связями
|
|
Атом водорода имеет только один электрон, который позволяет вступать ему в соединение только с одним атомом. Однако при некоторых условиях атом водорода может быть связан силами притяжения одновременно с двумя атомами, образуя тем самым водородную связь. Энергия такой связи составляет ~ 0, 1 эВ.
Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Важно, чтобы у этих электроотрицательных атомов были неподеленные электронные пары. Поэтому водородные связи характерны для таких веществ, как вода H2O, аммиак NH3, фтороводород HF.
В предельном случае, когда водородная связь носит чисто ионный характер, атом водорода теряет свой единственный электрон и, отдавая его одному из атомов, превращается в протон, который и осуществляет связь между атомами. Малые размеры протона не позволяют ему иметь ближайшими соседями более двух атомов (рис.2.7).
| Рис.2.7. Водородная связь в кристалле HF |
Водородная связь О – Н в воде (на рис.2.8 она обозначена пунктиром) возникает при взаимодействии обедненного электронами атома водорода с зарядом 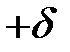 одной молекулы воды с неподеленной электронной парой атома кислорода с зарядом
одной молекулы воды с неподеленной электронной парой атома кислорода с зарядом 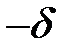 другой молекулы воды.
другой молекулы воды.
Рис.2.8. Водородная связь между молекулами воды: длина водородной связи 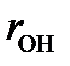 ~0, 276 нм ~0, 276 нм
|
Водородные связи примерно на порядок менее прочные, чем ковалентные, но именно они заставляют воду быть жидкостью или льдом (а не газом) в обычных условиях. Водородные связи разрушаются только тогда, когда жидкая вода переходит в пар.
Совершенно уникально влияние водородных связей на структуру и свойства воды и некоторых других веществ. Например, в отсутствие водородных связей вода кипела бы при –80o С и, разумеется, наша форма жизни была бы невозможна.
При температурах выше 0°С (но ниже температуры кипения) вода уже не имеет такую упорядоченную межмолекулярную структуру, как показано на рис.2.8. Поэтому в жидкой воде молекулы связаны между собой лишь в отдельные агрегаты из нескольких молекул. Эти агрегаты могут свободно перемещаться, образуя подвижную жидкость. Но при понижении температуры упорядоченность увеличивается, а агрегаты – укрупняются. Наконец, образуется лед, который имеет именно такую упорядоченную структуру, которая показана на рис.2.9.
| Рис.2.9. Схема структуры льда. Четыре водородных связи для каждого атома кислорода (большие кружки) направлены вдоль ребер тетраэдра. Каждый протон (маленькие кружочки) удален от атома кислорода в своей молекуле на 0, 101 нм и на 0, 175 нм от атома кислорода соседней молекулы |
В кристалле льда между молекулами остаются пустоты. Объем этих пустот больше, чем размер отдельной молекулы Н2О. Поэтому лед имеет меньшую плотность, чем жидкая вода и плавает на поверхности воды. Большинство же других веществ при замерзании увеличивает свою плотность.
Диэлектрические свойства воды и льда обусловлены возможностью вращения молекул и перескока пары протонов в новые позиции, что определяет новые водородные связи. Молекулы в кристалле льда могут занимать множество позиций, из которых равновесная определяется температурой и давлением; известно много структурных модификаций льда при высоких давлениях.
Еще одно проявление водородных связей – голубой цвет чистой воды в ее толще. Когда одна молекула воды колеблется, она заставляет колебаться и связанные с ней водородной связью другие молекулы. На возбуждение этих колебаний расходуются красные лучи солнечного спектра, как наиболее подходящие по энергии. Таким образом, из солнечного спектра " отфильтровываются" красные лучи – их энергия поглощается и рассеивается колеблющимися молекулами воды в виде тепла.
Водородные связи играют важную роль при полимеризации химических соединений таких, как  ,
, 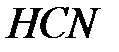 и
и 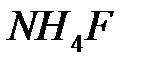 . Они существенны и в таких кристаллах, как дигидрофосфат калия
. Они существенны и в таких кристаллах, как дигидрофосфат калия 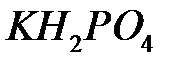 , обуславливая их сегнетоэлектрические свойства.
, обуславливая их сегнетоэлектрические свойства.
|
|