
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Молекулярные кристаллы
|
|
В таких кристаллах действуют ван-дер-ваальсовы силы связи, которые имеют электрическую природу и являются наиболее универсальными. Молекулярные силы состоят из взаимодействия разного типа: ориентационного (между полярными молекулами), индукционного (при высокой поляризуемости молекул) и дисперсионного.
Дисперсионное взаимодействие свойственно всем молекулам и является практически единственным в случае неполярных молекул. Эта связь впервые была объяснена на основе квантово-механического решения задачи о взаимодействии двух осцилляторов (Ф.Лондон[6], 1930). Наличие в осцилляторе минимальной, отличной от нуля энергии, которая уменьшается при сближении осцилляторов, и приводит к появлению дисперсионных сил взаимодействия, которые относятся к короткодействующим.
Неполярная молекула благодаря движению входящих в нее электронов может приобретать мгновенный дипольный момент – молекула поляризуется. Под действием этой поляризации возникает индуцируемый момент в соседней молекуле, и между ними устанавливается взаимодействие.
Кроме дисперсионных в молекулярных кристаллах могут действовать еще два типа сил – ориентационные в случае полярных молекул и индукционные при наличии молекул с высокой способностью поляризоваться. Обычно в кристаллах наблюдаются все три типа взаимодействия, хотя вклад каждого может быть различным. Энергия связи молекулярных кристаллов невелика и составляет менее 0, 1 эВ/атом. Поэтому соответствующие вещества имеют низкую точку плавления и низкую точку кипения. Для структуры кристаллов таких веществ часто характерна плотная упаковка. Инертные газы, будучи превращенными в твердое состояние, образуют кристаллы плотно упакованной кубической структуры.
Каждая молекула является своего рода квантовым осциллятором, поэтому количественные характеристики дисперсионного взаимодействия можно получить, решив квантово-механическую задачу о взаимодействии двух линейных гармонических осцилляторов с дипольными моментами 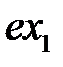 и
и  , находящихся на расстоянии
, находящихся на расстоянии 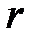 . Потенциальная энергия такой системы
. Потенциальная энергия такой системы
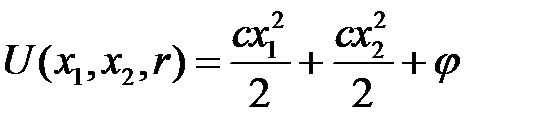 , (2.65)
, (2.65)
где  – коэффициент упругости диполя,
– коэффициент упругости диполя, 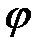 – потенциальная энергия взаимодействия двух диполей.
– потенциальная энергия взаимодействия двух диполей.
Определим  (в ед. абсолютной системы)
(в ед. абсолютной системы)
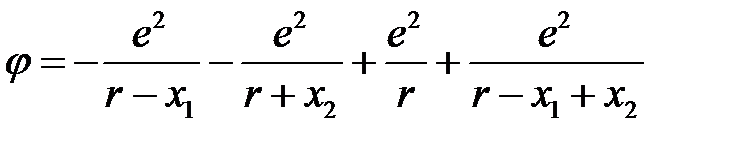 . (2.66)
. (2.66)
Раскладывая в ряд и сохраняя третьи члены разложения (при условии  ), получим
), получим
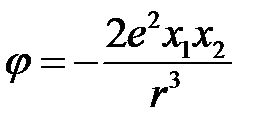 . (2.67)
. (2.67)
Введем нормальные координаты
 (2.68)
(2.68)
и преобразуем 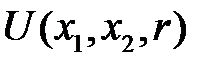 :
:
 . (2.69)
. (2.69)
Решение стационарного уравнения Шредингера для системы из двух осцилляторов
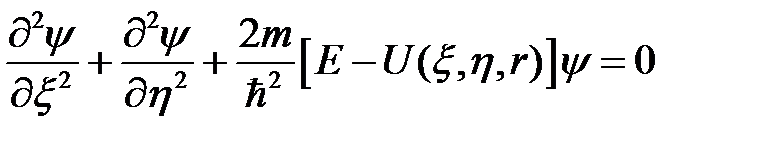 (2.70)
(2.70)
проводится методом разделения переменных. Условия разрешимости каждого из уравнений определяют дискретный энергетический спектр системы
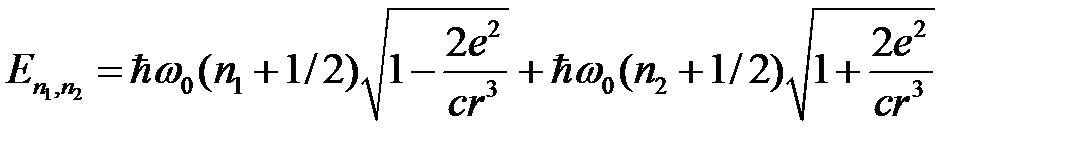 , (2.71)
, (2.71)
где  ;
; 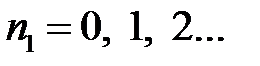 ;
; 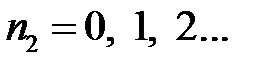 .
.
Определим «нулевую» энергию ( ) двух взаимодействующих осцилляторов, раскладывая радикалы в ряд до третьих членов:
) двух взаимодействующих осцилляторов, раскладывая радикалы в ряд до третьих членов:
 . (2.72)
. (2.72)
Учитывая, что «нулевая» энергия двух невзаимодействующих осцилляторов 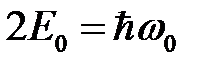 , получим энергию дисперсионного взаимодействия
, получим энергию дисперсионного взаимодействия
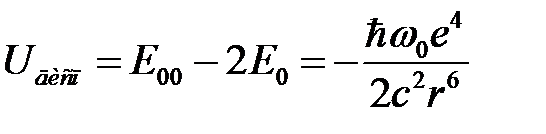 (СГС), (2.73)
(СГС), (2.73)
или
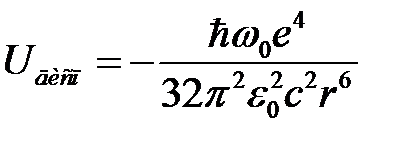 (СИ). (2.74)
(СИ). (2.74)
Из последнего выражения получаем силу дисперсионного взаимодействия
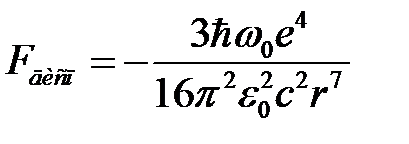 . (2.75)
. (2.75)
Следовательно, существование дисперсионных сил обязано наличию «нулевой» энергии атомов и молекул, уменьшающейся при их сближении. Дисперсионные силы, как видно из (2.75), относятся к короткодействующим.
Если молекулы обладают постоянными дипольными моментами или за счет большой поляризуемости молекул в них возникают индуцированные диполи, то появляется дополнительное дипольное взаимодействие. Под действием электрических сил молекулы стремятся ориентироваться друг относительно друга таким образом, чтобы энергия взаимодействия диполей уменьшилась. Эту ориентацию нарушает хаотическое тепловое движение.
При достаточно высоких температурах, когда энергия взаимодействия двух диполей 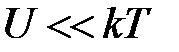 , энергия ориентационного взаимодействия равна
, энергия ориентационного взаимодействия равна
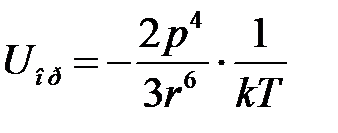 , (2.76)
, (2.76)
где  – дипольный момент.
– дипольный момент.
При низких температурах 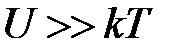 , когда достигается полная ориентация диполей, энергия дипольного взаимодействия равна
, когда достигается полная ориентация диполей, энергия дипольного взаимодействия равна
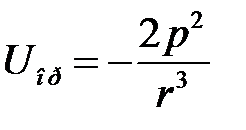 . (2.77)
. (2.77)
В молекулах с высокой поляризуемостью 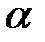 под действием электрического поля
под действием электрического поля 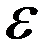 возникают индуцированные дипольные моменты
возникают индуцированные дипольные моменты  . Энергия взаимодействия индуцированных диполей не зависит от температуры и составляет
. Энергия взаимодействия индуцированных диполей не зависит от температуры и составляет
 . (2.78)
. (2.78)
В общем случае энергия взаимодействия молекул может складываться из различных частей, соответствующих ориентационному, индукционному и дисперсионному взаимодействию. Вклад каждого из них различный в зависимости от типа молекул (табл.2.2).
Наиболее универсальными являются дисперсионные силы, которые действуют не только между атомами с заполненными оболочками, но и между любыми атомами, ионами и молекулами.
Таблица 2.2. Характеристика межмолекулярного взаимодействия (%)
| Вещество | 
| 
| 
|
Вода, 
| |||
Аммиак, 
| |||
Окись углерода, 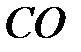
| |||
Метиловый спирт, 
|
При наличии сильных связей дисперсионное взаимодействие играет роль небольшой добавки. В других случаях дисперсионное взаимодействие составляет значительную долю общего межмолекулярного взаимодействия, а в некоторых случаях, например, для кристаллов инертных элементов, является единственным типом сил притяжения.
|
|