
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Изотерма химической реакции
|
|
Изотерма химической реакции (изотерма Вант-Гоффа) – это уравнение показывающее связь энергии Гиббса (Δ G, при Р=const.) или энергии Гельмгольца (Δ F, при V=const.) с константой равновесия при постоянной температуре.
Из уравнения Аррениуса (6.7.3) следует, что константа скорости пропорциональна 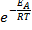 , тогда константа равановесия КР будет пропорциональна
, тогда константа равановесия КР будет пропорциональна 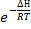 . Учитывая энтропийный фактор, можно записать, что при постоянном давлении:
. Учитывая энтропийный фактор, можно записать, что при постоянном давлении:
Δ G = -RTlnKp (6.12)
Аналогичное уравнение при постоянном объеме
Δ F = -RTlnKv (6.13)
Оба эти соотношения получили название изотермы химических реакций и имеют большое значение для расчетов термадинамических и кинетических параметров.
Рассмотрим возможные значения параметров этих уравнений для различных реакций.
1. Равновесие в реакции смещено вправо, Kp> 1, тогда при данной температуре Δ G< 0.
2. Равновесие в реакции смещено влево, Kp< 1, тогда при данной температуре Δ G> 0.
3. Равновесие в реакции установилось посередине (концентрации исходных веществ и продуктов одинаковые), Kp=1, тогда при данной температуре G=0.
Уравнения изотермы Вант-Гоффа позволяют рассчитать максимальную работу химической реакции и тем самым определить возможность её самопроизвольного протекания в каких-либо конкретных условиях (при температуре Т и концентрациях реагентов ci или парциальных давлениях pi).
|
|