
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Определение скорости химической реакции
|
|
Скорость химической реакции — изменение количества вещества одного из реагирующих веществ за единицу времени в единице реакционного пространства.
Более точно скорость реакции определяется числом элементраных актов протекающих в единицу времени в единице объема для гомогенных реакций или на единице поверхности для гетерогенных:
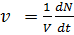 – гомогенная реакция (6.1)
– гомогенная реакция (6.1)
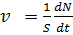 – гетерогенная реакция (6.2)
– гетерогенная реакция (6.2)
Понятие скорости является ключевым в химической кинетике. На практике скорость химической реакции удобнее определять по изменению концентрации реагирующих веществ при этом если измерения проводятся за конечный промежуток времени то получают среденее значение скорости: 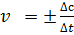 , величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то отношение изменения концентрации к изменению времени берется со знаком минус. Более точное мгновенное значение скорости представим в виде производной:
, величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрация которого убывает в процессе реакции), то отношение изменения концентрации к изменению времени берется со знаком минус. Более точное мгновенное значение скорости представим в виде производной: 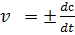
6.2.2. Основной закон химической кинетики – закон «действующих масс»
Активное изучение скоростей реакций началось еще в начале 19 века. Однако, все эти исследования носили в основном экспериментальный характер. В 1865 году Н. Н. Бекетов обнаружил, что в некоторых гетерогенных процессах (вытеснение водородом металлов из растворов их солей) скорость реакции зависит от давления газа.
Полученные Бекетовым, и другими учеными экспериментальные данные позволили в 1867 году норвежским химикам К. Гульдбергу и П. Вааге сформулировать закон, устанавливающий соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Авторы назвали «действующей массой» вещества его количество в единице объёма, т. е. концентрацию, отсюда — наименование закона.
Закон действующих масс в современной форме (основное уравнение кинетики) для простых реакций можно записать так:
При постоянной температуре скорость элементарной химической реакции прямопропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции:
a1A1 + a2A2 + a3A3 +…= b1B1 + b2B2 + b3B3 +… или 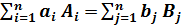 ,
,
получаем уравнение связывающее скорость реакции и концентрации:
v=k 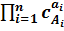 (6.3)
(6.3)
здесь v – скорость реакции, k – коэффициент пропорцианальности или константа скорости, сАi – концентрация i-го исходного вещества аi – стехиометрические коэффициенты.
В общем случае для всех реакций, включая сложные, формулировку закона немного изменим – скорость химической реакции в каждый момент времени прямопропорциональна произведению концентраций реагентов, возведенным в некоторые степени:
v=k 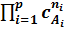 , (6.4).
, (6.4).
Уравнение 6.3 отличается от уравнения 6.4 только показателями степеней, в которые возводятся концентрации. Для простых реакций показатель степени при значении концентрации каждого вещества равен его стехиометрическому коэффициенту, для сложных реакций это правило может не соблюдатся. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
· природа реагирующих веществ;
· наличие катализатора;
· температура (правило Вант-Гоффа);
· площадь поверхности реагирующих веществ.
|
|