
Главная страница
Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
|
Кривая потенциальной энергии
Таким образом, для описания движения АК при распаде в продукты можно использовать скорость по направлению разрываемой связи, полученную в кинетической теории газов:
x kБT, где m * - эффективная масса активированного комплекса, т.к. скорость зависит от соотношения общей и потенциальной энергий.
 Рис.6.8. Энергетическая координата реакции.
Рис.6.8. Энергетическая координата реакции.
| 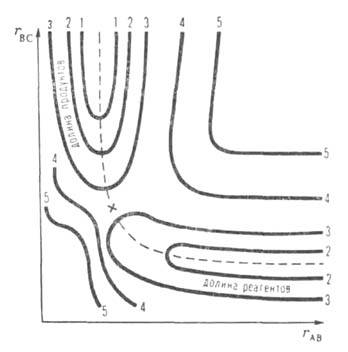 Рис.6.7. Двухмерная кривая потенциальной энергии
Рис.6.7. Двухмерная кривая потенциальной энергии
| Для системы частиц (атомов, молекул), между которыми может происходить реакция ППЭ - функция потенциальной энергии атомных ядер U от их пространственных координат, или степеней свободы. В системе из n ядер число степеней свободы N = 3n-6 (или 3n-5, если все ядра расположены на одной прямой линии). Простейшая двухмерная (N = 2) ППЭ показана на рис. 6.7. Реагентам и продуктам реакции на ней соответствуют области относительно небольшой потенциальной энергии (долины), разделенные областью повышенной энергии – потенциальным барьером. Кривая линия, проходящая по дну долин через барьер – координата реакции. Часто используют одномерные схемы, изображающие сечение ППЭ, развернутое вдоль координаты реакции (см. рис. 6.8.). На этих схемах вершине потенциального барьера соответствует седловая точка, или точка перевала. Эти же понятия переносят на многомерные ППЭ с N > 2. Состояния реагентов и продуктов устойчивы, им соответствуют конфигурации (т.е. фиксированные значения координат), которые являются минимумами (или долинами) на многомерной ППЭ. Химическая реакция рассматривается как переход из конфигурации реагентов в конфигурацию продуктов через конфигурацию седловой точки вдоль координаты реакции. Максимум на кривой, соответствует энергии активированного комплекса, а разность между этой энергией и энергией исходного состояния – энергии активации (ЕА). Для обратной реакции энергия активации будет равна разности энергии активированного комплекса и энергии продуктов, следовательно энтальпия реакции (Δ Н) оказывается равной разности энергий активации прямой и обратной реакции.
|

 Рис.6.7. Двухмерная кривая потенциальной энергии
Рис.6.7. Двухмерная кривая потенциальной энергии