
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическое равновесие.
|
|
Это понятие применимо только для обратимых реакций, которые могут протекать как в прямом, так и в обратном направлениях. Обратимые реакции не доходят до конца и заканчиваются установлением равновесия, при котором скорости прямой и обратной реакции равны. В случае обратимой химической реакции aA+bB = cC+dD константа равновесия будет равна  , где [A], [B], [C], [D] – равновесные концентрации;
, где [A], [B], [C], [D] – равновесные концентрации;
a, b, c, d - стехиометрические коэффициенты в уравнении реакции. Чем больше K, тем больше в реакционной системе в момент равновесия концентрации конечных продуктов. Константа равновесия зависит от природы реагирующих веществ, от температуры, от давления (в случае неконденсированных систем) и не зависит от начальных концентраций реагирующих веществ.
При неизменных условиях химическое равновесие сохраняется сколь угодно долго. При изменении условий равновесие нарушается. Направление смещения равновесия определяется принципом Ла – Шателье: если на систему, находящуюся в равновесии оказать внешнее воздействие (изменить температуру, давление, концентрации участвующих в реакции веществ), то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено.
Так, повышение температуры приводит к смещению равновесия в направлении реакции, сопровождающейся поглощением теплоты, т. е. охлаждением системы, повышение давления вызывает смещение равновесия в направлении уменьшения общего числа молей газообразных веществ, т. е. в направлении, приводящем к понижению давления; удаление из системы одного из продуктов реакции ведёт к смещению равновесия в сторону прямой реакции; уменьшение концентрации одного из исходных веществ приводит к сдвигу равновесия в направлении обратной реакции.
Константа равновесия химической реакции связана со стандартным изменением энергии Гиббса этой реакции уравнением: ∆ G0T= -2, 3 RT lg KT.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Вопросы для самоконтроля по теме: «Закономерности протекания химических реакций»
1. Что называется тепловым эффектом химической реакции?
2. Сформулировать закон Гесса и следствие из него.
3. Дать определение стандартной величины энтальпии образования вещества.
4. Что представляет собой термохимическое уравнение?
5. Какие реакции называются экзо- и эндотермическими?
6. В каком направлении химические реакции протекают самопроизвольно?
7. Как изменяется энтропия в процессах: кристаллизации, конденсации, сжатии, полимеризации?
8. Дать определение скорости химической реакции.
9. Сформулировать закон действия масс, правило Вант – Гоффа.
10. От каких факторов зависит скорость химической реакции?
11. Для каких реакций применимо понятие химического равновесия?
12. Что показывает величина константы равновесия?
13. От чего зависит константа равновесия?
14. В каком направлении сместится равновесие реакции при повышении температуры? CO (г)+2H2(г)=CH3OH (г)+  H
H
Задачи по теме:
“Энергетика химической реакции”
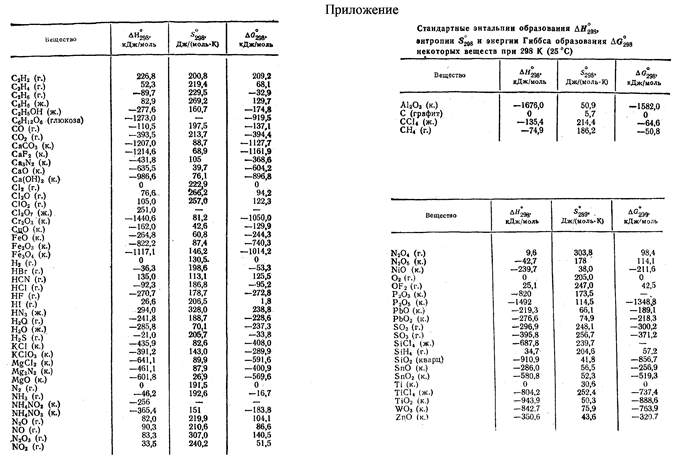
№1 Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
FeO(к)+CO(г) = Fe(к)+CO2(г); ∆ H = -13, 18 кДж
CO(г)+1/2O2(г)=CO2(г); ∆ H = -283, 0 кДж
H2(г)+1/2O2(г)=H2O(г); ∆ H = -241, 83 кДж.
№2 При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод CS2(г). Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект.
№3 При восстановлении 12, 7 г оксида Cu(II) углем (с образованием угарного газа) поглощается 8, 24 кДж тепла. Определить ∆ Н°298 образования CuO.
№4 Исходя из уравнения реакции CH3OH(ж)+3/2O2(г)=CO2(г)+2H2O(ж) ∆ Н°=-726, 5 кДж вычислить ∆ Н°298 образования метилового спирта.
№5 Вычислите ∆ Н°, ∆ S°, ∆ GT° реакции, протекающей по уравнению Fe2O3(к)+3C=2Fe+3CO. Возможна ли реакция восстановления Fe2O3 углеродом при температуре: 500 или 1000К.
№6 При какой температуре наступит равновесие системы 4HCl(г)+O2(г)=2H2O(г)+2Cl2(г) ∆ Н=-114, 42 кДж. Хлор или кислород в этой системе является более сильным окислителем и при каких температурах?
№7 Прямая или обратная реакция будет протекать при стандартных условиях в системе: СН4(г)+СО2(г)=2СО(г) + 2Н2(г).
№8 На основании стандартных теплот образования и стандартных энтропий веществ вычислить ∆ G˚ 298 реакции: СО(г)+Н2О(ж)=СО2(г)+Н2(г).
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
№9 Пользуясь табличными данными вычислить ∆ Н реакции 2Mg(к)+CO2(г)=2MgO(к) + C(к).
№10 При сжигании серы выделилось 73, 48 кДж тепла и получилось 16г SO2. Вычислить теплоту образования SO2.
№11 Указать, какие из реакций образования оксидов азота и при каких температурах (высоких или низких) могут в стандартных условиях протекать самопроизвольно:
а) 2N2(г)+O2(г)=2N20(г); ∆ H˚ 298> 0
б) N2(г)+O2(г)=2NO(г); ∆ H˚ 298> 0
в) 2NO(г)+O2(г)=2NO2(к); ∆ H˚ 298< 0
г) NO(г)+NO2(г)=N2O3(к); ∆ H˚ 298< 0
д) N2(к)+2O2(г)=2NO2(г); ∆ H˚ 298> 0
№12 Вычислите изменение энтропии для реакций, протекающих по уравнениям:
2CH4(г)=C2H2(г)+3H2(г)
N2(г)+3H2(г)=2NH3(г)
C(графит)+O2(г)=CO2(г)
Почему в этих реакциях ∆ S˚ 298> 0; < 0; ≈ 0?
 |
|
|
