
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Раздел химии, рассматривающий скорости и механизм химических реакций, называется химической кинетикой.
|
|
Скорость химической реакции измеряется количеством вещества, вступающего в реакцию или образующегося в результате реакции в единицу времени в единице объёма системы (для гомогенной реакции) или на единице площади поверхности раздела фаз (для гетерогенной реакции). Скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов.
Закон действия масс: скорость химической реакции прямо пропорционально произведению концентраций реагирующих веществ, взятых степенях, равных их стехиометрическим коэффициентам.
Для реакции аА+bB®cC+dD закон действия масс будет выглядеть так: u=k∙ [A]a∙ [B]b, где
[A] и [B] – концентрации вступающих в реакцию веществ;
a, b – стехиометрические коэффициенты;
k – константа скорости реакции, зависящая от природы реагирующих веществ и от температуры.
При гетерогенных реакциях концентрации веществ, находящихся в твёрдой фазе, обычно не изменяются в ходе реакции и поэтому не включаются в уравнение закона действия масс.
Зависимость скорости гомогенной реакции от температуры приближённо описывается эмпирическим правилом Вант - Гоффа: при нагревании на 100 константа скорости увеличивается в 2-4 раза, т. е. kt+10/kt=2-4=g, где kt – константа скорости при температуре t, kt+10 – константа скорости при температуре t+10, g - температурный коэффициент.
В общем случае, если температура изменилась на  t:
t:
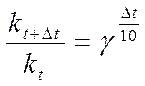
Вещества, которые изменяют скорость химического процесса, оставаясь при этом неизменными, называются катализаторами. Различают гомогенный и гетерогенный катализ в зависимости от того находится ли катализатор в той же фазе, что и реагирующие вещества или образует самостоятельную фазу. Действие катализатора связано с тем, что он вступает в промежуточное взаимодействие с реагирующими веществами, направляя процесс по новому пути с меньшей энергией активации.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
|
|
