
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Механизм расслабления
|
|
Существует два основных пути для реализации механизмов расслабления гладкой мышцы: либо уменьшить внутриклеточную концентрацию ионов Ca2+, либо увеличить активность фосфатазы легких цепей миозина [207, 243, 301].
1. Наиболее эффективным и часто встречающимся способом расслабления гладких мышц является снижение концентрации свободного Са2+ в саркоплазме. Это достигается несколькими способами – либо выведением избытка Са2+ из клетки с участием Са2+-АТФазы, Na/Ca обменника и закачивание Са2+ в цистерны саркоплазматического ретикулума, либо ионы Са2+ могут быть связаны внутриклеточными Са-связывающими белками и транспортированы в митохондрии [156]. В связи с тем, что гладкие мышцы не обладают развитым саркоплазматическим ретикулумом (в отличие от скелетных мышц), роль депо Са2+ не столь существенна по сравнению с выбросом Са2+ во внеклеточное пространство.
Через клеточную мембрану ионы кальция удаляются либо с помощью Na-Ca обменника, либо с помощью Са2+ насоса (Са, Mg–АТФаза, Са, Н-АТФаза). У большинства гладкомышечных клеток на плазматической мембране имеется система активного транспорта, которая удаляет ионы Са2+ из клетки - PMCA (plasma-membrane Ca2+-ATPase). Существует четыре изоформы РМСА [200, 240]. Кальциевый насос плазматической мембраны в результате гидролиза АТФ обменивает один ион Н+ на один ион Са2+.
Кроме этого, для процесса расслабления также большое значение имеет гиперполяризация плазматической мембраны, вызванная активацией калиевых каналов [294].
Одним из механизмом уменьшения количества ионов кальция до уровня покоя является ресеквестрация Са2+ в саркоплазматический ретикулум. Этот процесс осуществляется с помощью SERCA- типа кальциевого насоса [47].
Кальциевый насос на мембране саркоплазматического ретикулума мышечной клетки имеет аббревиатуру SERCA (sarcoplasmic and endoplasmic reticulum calcium ATPase). SERCA играет важнейшую роль в активной ресеквестрации ионов Са2+ в саркоплазматический ретикулум. В процессе работы SERCA гидролиз одной АТФ сопровождается транспортом двух ионов Са2+ в саркоплазматический ретикулум в обмен на два иона Н+ [95].
Ca, Mg-АТФаза может располагаться как на мембране саркоплазматического ретикулума, так и на плазматической мембране. Ионы Mg2+ необходимы для активации фермента – они связываются с каталитическим сайтом АТФазы.
Скорость ресеквестрации зависит от активности Са2+ насоса саркоплазматического ретикулума и может регулироваться. Высокая концентрация ионов Са2+ внутри саркоплазматического ретикулума ингибирует активность Са2+ насоса. В гладкой мышце присутствует регуляторный белок фосфоламбан, который может ингибировать активность Са2+ насоса саркоплазматического ретикулума [111]. Этот белок также имеется в сердечной и в медленной скелетной мышце, но отсутствует в быстрых скелетных мышцах. Ионы кальция в саркоплазматическом ретикулуме связываются со специфическими Са2+ связывающими белками – кальсеквестрином и кальретикулином. Основным Са2+ связывающим белком скелетной мышцы является кальсеквестрин, который также обнаружен и в сердечной и в гладкой мышце. Кальретикулин в достаточно большом количестве имеется в саркоплазматическом ретикулуме гладкой мышцы. Эти белки обладают огромной способностью связывать ионы Са2+: до 50 сайтов связывания на одну молекулу белка [69, 256].
Са2+ связывающие белки имеют специфическую локализацию в саркоплазматическом ретикулуме. Например, кальсеквестрин локализуется в основном в области саркоплазматического ретикулума непосредственно под триадой, формируя комплекс с Са2+ каналами саркоплазматического ретикулума и особыми белками - юнктином и триадином.
2. Другим механизмом, приводящим к торможению процесса сокращения, является инактивация киназы легких цепей миозина, причем этот процесс происходит значительно раньше понижения уровня цитозольного Са2+. Обычно фосфорилирование киназы легких цепей миозина приводит к понижению на порядок сродства киназы легких цепей миозина к комплексу Са2+-кальмодулин. Вследствие этого снижается активность киназы легких цепей миозина. Таким образом, Са2+ одновременно индуцирует процесс сокращения и по механизму отрицательной обратной связи запускает механизмы его торможения.
Как уже отмечалось выше, для инициации сокращения гладкой мышцы необходимо фосфорилирование регуляторной легкой цепи миозина, которое запускается увеличением внутриклеточной концентрации ионов Са2+. Расслабление гладкой мышцы осуществляется с помощью дефосфорилирования легких цепей миозина с участием фосфатазы легких цепей миозина (рис.19). Фосфатаза легких цепей миозина также снижает АТФ-азную активность миозина до базального уровня. Этот фермент является гетеротримером, состоящим из субъединиц с молекулярной массой 130, 20 и 37 кДа. Субъединица с молекулярной массой 130 кДа может специфически связываться с миозином. Субъединица с молекулярной массой 37 кДа является каталитической субъединицей, ответственной за процесс дефосфорилирования [142, 302, 309]. Существуют природные ингибиторы фосфатаз, которые вызывают устойчивое сокращение гладких мышц – таутомицин, микроцистин-LR и окадаевая кислота [110].
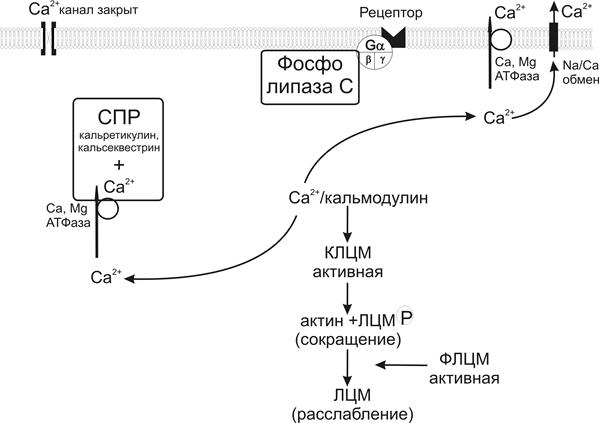
Рис.19. С хема основных механизмов расслабления в гладкомышечной клетке (объяснение в тексте). СПР - саркоплазматический ретикулум, ИФ3 – инозитол-1, 4, 5-трифосфат, ДГ – диацилглицерол, КЛЦМ – киназа легких цепей миозина, ФЛЦМ – фосфатаза легких цепей миозина.
В регуляции активности фосфатазы легких цепей миозина большую роль играет небольшой G-протеин RhoA и его мишень Rho киназа. Rho киназа, относящаяся к классу серин/треонин киназ, фосфорилирует миозин-связывающую субъединицу фосфатазы легких цепей миозина и ингибирует ее активность, обеспечивая фосфорилированное состояние легкой цепи миозина. Ингибирование Rho киназы вызывает расслабление гладких мышц артерий и приводит к понижению кровяного давления. [58, 99, 130, 268, 334]. В гладкой мышце обнаружен особый так называемый фактор обмена гуаниновых нуклеотидов – RhoGEF, который ускоряет активацию RhoА. Таким образом, повышенная экспрессия и/или активность RhoGEF может усилить активацию сокращения гладкой мышцы и может сыграть определенную патофизиологическую роль при таких заболеваниях, как гипертензия, астма и т.п.
Обобщая то, что известно о процессе сокращения и расслабления гладкой мышцы, можно сказать, что уровень фосфорилирования легких цепей миозина контролируется ферментами с противоположным характером действия: киназой и фосфатазой легких цепей миозина и зависит от баланса их активности.
|
|
