
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Полный гидролиз
|
|
Гидролиз солей, образованных очень слабым основанием и слабой летучей/нерастворимой кислотой, протекает до конца по всем стадиям и является необратимым.
Такие соли в растворах не существуют, так как полностью разлагаются водой с выпадением осадка и выделением газа.
Полному гидролизу подвергаются, например, карбонаты, сульфиды и силикаты трехвалентных металлов (Al3+, Cr3+, Fe3+).
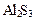 → ←
→ ← 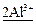 +
+ 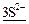
Записываются ионные уравнения по всем стадиям:
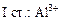 + HOH →
+ HOH → 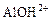 +
+ 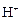
 + HOH →
+ HOH → 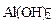 +
+ 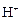
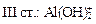 + HOH → Al(OH)3 +
+ HOH → Al(OH)3 + 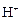
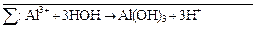
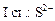 + HOH →
+ HOH → 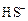 +
+ 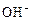
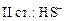 + HOH → H2S +
+ HOH → H2S + 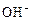
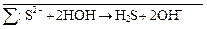
Затем вместе записываются суммарные ионные уравнения по катиону и аниону. Определяются множители, на которые надо домножить каждое уравнение, чтобы из катиона и аниона получить нейтральную молекулу:
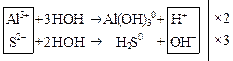
Al2S3 + 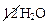 → 2Al(OH)3↓ + 3H2S↑ +
→ 2Al(OH)3↓ + 3H2S↑ + 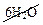
Al2S3 + 6H2O → 2Al(OH)3↓ + 3H2S↑
При растворении сульфида алюминия в воде выпадает белый осадок гидроксида алюминия и выделяется сероводород.
Полный гидролиз происходит также при смешении растворов двух солей, гидролизующихся по противоположному типу.
При сливании растворов AlCl3 и Na2S вместо образования сульфида алюминия выпадет осадок Al(OH)3 и появится запах выделяющегося сероводорода.
Суммарное молекулярное уравнение получается при сложении уравнения обменной реакции солей и суммарного уравнения гидролиза образующегося в результате этого обмена Al2S3:
2AlCl3 + 3Na2S + 6H2O → 2Al(OH)3↓ + 3H2S↑ + 6NaCl
|
|
