
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Гидролизу подвергаются только соли, образованные слабым основанием или слабой кислотой.
|
|
Алгоритм составления уравнений гидролиза
Пример: Написать уравнения гидролиза CuSO4 в ионной и молекулярной форме и определить значение рН в растворе соли.
1. Написать уравнение диссоциации соли:
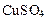 → ←
→ ← 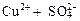
2. Определить силу основания и кислоты, образующих соль.
Ион слабого электролита подчеркнуть.
Слабые основания: нерастворимые, а также NH4OH.
Слабые кислоты: все, кроме HCl, HBr, HJ, H2SO4, HNO3, HClO4, HMnO4, H2Cr2O7.
Гидролиз идет только по слабому иону!
Соль CuSO4 образована слабым основанием Cu(OH)2 и сильной кислотой H2SO4:
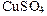 → ←
→ ← 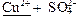
3. Написать сокращенное ионное уравнение гидролиза по иону слабого электролита.
Катионы (Kt+) связываются с гидроксид-ионами 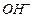 .
.
Анионы 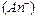 – с протонами
– с протонами 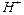 , входящими в состав воды.
, входящими в состав воды.
Гидролиз протекает только по первой ступени!
Общий заряд иона CuOH+ получается при сложении зарядов составляющих его ионов Cu2+ и 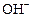 :
:
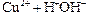 → ←
→ ← 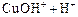
4. Дополнить имеющиеся ионы соответствующими противоионами, которые образовались при диссоциации соли:
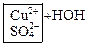 → ←
→ ← 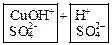
5. Составить молекулярное уравнение, объединив ионы с противоионами в таком соотношении, чтобы в сумме их заряд, учитывая индексы, был равен нулю.
При необходимости расставить коэффициенты:
 → ←
→ ← 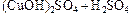
6. Определить характер среды и значение рН в растворе.
В растворе CuSO4 накапливаются ионы 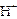 : среда кислая, рН < 7.
: среда кислая, рН < 7.
|
|