
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Многомолекулярная локализованная адсорбция. Изотерма адсорбции Ленгмюра.
|
|
Мономолекулярная адсорбция — адсорбция происходит в один слой. Локализованная адсорбция — если адсорбированные молекулы закреплены на адсорбционных центрах и при этом выделяется максимум энергии.

Модель Ленгмюра: 1) Если молекула попадает на свободный адсорбционный центр, то она остается на нем. 2) Если молекула попадает на занятый адсорбционный центр, то она уходит с поверхности. 3) Адсорбирование имеет место только на определенные адсорбционные центры. 4) Если все адсорбционные центры заняты, то наступает предел адсорбции.
 - число адсорбционных центров на единицу поверхности.
- число адсорбционных центров на единицу поверхности.
 - число занятых адсорбционных центров на единицу поверхности.
- число занятых адсорбционных центров на единицу поверхности.
 - число доступных для адсорбции адсорбционных центров на единицу поверхности.
- число доступных для адсорбции адсорбционных центров на единицу поверхности.
Вероятность того, что молекула, ударяющаяся о поверхность будет адсорбирована равна:  И з кинетической теории газов. Число адсорбированных молекул в единицу времени:
И з кинетической теории газов. Число адсорбированных молекул в единицу времени:  Если это выражение помножить на время жизни одной адсорбированной молекулы, то получим выражение, которое показывает число молекул, находящихся в
Если это выражение помножить на время жизни одной адсорбированной молекулы, то получим выражение, которое показывает число молекул, находящихся в  поверхности:
поверхности:
 Степень заполняемости поверхности:
Степень заполняемости поверхности:  И введем обозначение:
И введем обозначение: 


Данное выражение показывает зависимость адсорбции от давления при постоянной температуре и носит название изотермы адсорбции Ленгмюра.
Полимолекулярная адсорбция. Полимолекулярная адсорбция характерна для адсорбции газов, в случае, если газы не реагируют с поверхностью и не разлагаются на ней.
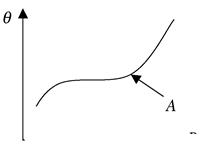

Теплота адсорбции 2 слоя атомов или молекул очень мала. Изотермы паров при Т < Ткип часто имеют S -образную форму. В точке A внешнее давление приближается к давлению насыщенных паров и происходит объемная конденсация паров. Такая адсорбция называется /Т < Т/ полимолекулярной. Для того, чтобы имела место полимолекулярная адсорбция, необходимо, чтобы время жизни молекул второго слоя было соизмеримо со временем изни молекул первого слоя. В противном случае (Т2 < ТХ) наблюдается ономолекулярная адсорбция. Взаимодействие между (1 и 2), (2 и 3) и т.д. слоями определяется энергией конденсации. При адсорбции пара молекулы, попадая на уже занятую поверхность, образуют адсорбционные комплексы второго слоя. Между молекулами одного слоя и молекулами следующего слоя существует взаимодействие и оно постоянно для молекул этих двух слоев. Молекулы любого отдельно взятого слоя не взаимодействуют друг с другом. Начиная со второго слоя адсорбция и десорбция протекают так же как в жидкостях и теплота адсорбции равна теплоте конденсации.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Уравнение изотермы Брунауэра-Эммета-Теллера

 - текущее давление.
- текущее давление. 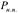 - давление насыщенных паров. Если
- давление насыщенных паров. Если 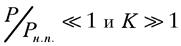 , то уравнение БЭТ упрощается:
, то уравнение БЭТ упрощается:  Принимая
Принимая 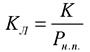 при данных условиях БЭТ вырождается в уравнение адсорбции Ленгмюра. Таким образом уравнение адсорбции Ленгмюра описывает адсорбцию при давлениях пара гораздо меньших, чем давление насыщенного пара.
при данных условиях БЭТ вырождается в уравнение адсорбции Ленгмюра. Таким образом уравнение адсорбции Ленгмюра описывает адсорбцию при давлениях пара гораздо меньших, чем давление насыщенного пара.
Диффузия. Определение и основные понятия.
Диффузия — процесс переноса материи или энергии из области с высокой концентрацией в область с низкой концентрацией. Самым известным примером диффузии является перемешивание газов или жидкостей. Все виды диффузии подчиняются одинаковым законам. Скорость диффузии пропорциональна площади поперечного сечения образца, а также разности концентраций, температур или зарядов (в случае относительно небольших величин этих параметров). Так тепло будет в четыре раза быстрее распространяться через стержень с диаметром в два сантиметра, чем через стержень с диаметром в один сантиметр. Это тепло будет распространяться в два раза быстрее, если перепад температур на одном сантиметре будет 10 º C вместо 5 º C. Скорость диффузии пропорциональна также параметру, характеризующему конкретный материал. В случае тепловой диффузии этот параметр называется теплопроводность, в случае потока электрических зарядов — электропроводность. Количество вещества, которое диффундирует в течение определённого времени и расстояние, проходимое диффундирующим веществом, пропорциональны квадратному корню времени. Диффузия представляет собой процесс на молекулярном уровне и определяется случайным характером движения отдельных молекул. Скорость диффузии пропорциональна в связи с этим средней скорости молекул. В случае газов средняя скорость малых молекул больше, а именно она обратно пропорциональна квадратному корню из массы молекулы и растёт с повышением температуры. Диффузионные процессы в твёрдых телах при высоких температурах часто находят практическое применение. С точки зрения термодинамики движущим потенциалом любого выравнивающего процесса является рост энтропии. При постоянных давлении и температуре в роли такого потенциала выступает химический потенциал µ, обуславливающий поддержание потоков вещества. Поток частиц вещества пропорционален при этом градиенту потенциала J ~  . В большинстве практических случаев вместо химического потенциала применяется концентрация C. Прямая замена µ на C становится некорректной в случае малых концентраций, так как химический потенциал связан с концентрацией по логарифмическому закону. Если не рассматривать такие случаи, то выше приведённую формулу можно заменить на следующую:
. В большинстве практических случаев вместо химического потенциала применяется концентрация C. Прямая замена µ на C становится некорректной в случае малых концентраций, так как химический потенциал связан с концентрацией по логарифмическому закону. Если не рассматривать такие случаи, то выше приведённую формулу можно заменить на следующую:  . которая показывает, что плотность потока вещества J [cm - 2s - 1] пропорциональна коэффициенту диффузии D [(cm2s - 1)] и градиенту концентрации. Это уравнение выражает первый закон Фика (Адольф Фик — немецкий физиолог, установивший законы диффузии в 1855 г.). Второй закон Фика связывает пространственное и временное изменения концентрации (уравнение диффузии):
. которая показывает, что плотность потока вещества J [cm - 2s - 1] пропорциональна коэффициенту диффузии D [(cm2s - 1)] и градиенту концентрации. Это уравнение выражает первый закон Фика (Адольф Фик — немецкий физиолог, установивший законы диффузии в 1855 г.). Второй закон Фика связывает пространственное и временное изменения концентрации (уравнение диффузии):  . Коэффициент диффузии D зависит от температуры. В ряде случаев в широком интервале температур эта зависимость представляет собой уравнение Аррениуса. Дополнительное поле, наложенное параллельно градиенту химического потенциала, нарушает стационарное состояние. В этом случае диффузионные процессы описываются нелинейным уравнением Фоккерa—Планка
. Коэффициент диффузии D зависит от температуры. В ряде случаев в широком интервале температур эта зависимость представляет собой уравнение Аррениуса. Дополнительное поле, наложенное параллельно градиенту химического потенциала, нарушает стационарное состояние. В этом случае диффузионные процессы описываются нелинейным уравнением Фоккерa—Планка
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
|
|
