
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Уравнение Клапейрона — Клаузиуса
|
|
Уравнение Клапейрона-Клаузиуса — основное уравнение, описывающее фазовые превращения.
Рассмотрим G = H-TS - энергию Гиббса, так как процесс изотермический для индивидуального вещества.
Энтальпия есть H = U + PV, тогда
G = U + PV - TS. Продифференцируем:
dG = dU + PdV + VdP - TdS - SdT
Рассмотрим изолированную систему, находящуюся в равновесии (например, жидкость-пар). Равновесие заключается в том, что за единицу времени определенное число молекул переходит из жидкой фазы в газообразную. За это же самое время ровно такое же число молекул переходит из газообразной фазы в жидкую.

Это значит, что
- химический потенциал компонента системы.
В изолированной системе равновесие при dS = 0.
Также учтем, что

dG=dU+PdV+VdP-TdS-SdT (dU=0; dV=0; dS=0)
dG=VdP-SdT
dG1=V1dP-S1dT
dG2=V2dP-S2dT

Перейдем к конечным разностям AG = VAP - SAT. Рассмотрим две фазы:
Вычтем из выражения (2) выражение (1):

|
- изменение энтропии при фазовом переходе;
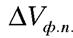
|
- изменение объема при фазовом переходе;

Так как температура фазового перехода зависит от давления, то индекс ф.п. опускаем.

Клапейрона — Клаузиуса уравнение, термодинамическое уравнение, относящееся к процессам перехода вещества из одной фазы в другую (испарение, плавление, сублимация, полиморфное превращение и др.). Согласно К. — К. у теплота фазового перехода (например, теплота испарения, теплота плавления) при равновесно протекающем процессе определяется выражением

 , (1)
, (1)
где Т — температура перехода (процесс изотермический), dp/dT — значение производной от давления по температуре при данной температуре перехода, (V2—V1) — изменение объёма вещества при переходе его из первой фазы во вторую.
Первоначально уравнение было получено в 1834 Б. П. Э. Клапейроном из анализа Карно цикла для конденсирующегося пара, находящегося в тепловом равновесии с жидкостью. В 1850 P. Клаузиус усовершенствовал уравнение и распространил его на др. фазовые переходы. К. — К. у. применимо к любым фазовым переходам, сопровождающимся поглощением или выделением теплоты (т. н. фазовым переходом 1 рода), и является прямым следствием условий фазового равновесия, из которых оно и выводится.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
К. — К. у. может служить для расчёта любой из величин, входящих в уравнение, если остальные известны. В частности, с его помощью рассчитывают теплоты испарения, экспериментальное определение которых сопряжено со значительными трудностями.
Часто К. — К. у. записывают относительно производных dp/dT или dT/dp:
 (2)
(2)
Для процессов испарения и сублимации dp/dT выражает изменение давления насыщенного пара р с температурой Т, а для процессов плавления и полиморфного превращения dT/dp определяет изменение температуры перехода с давлением. Иными словами, К. — К. у. является дифференциальным уравнением кривой фазового равновесия в переменных р, Т.
Для решения К. — К. у. необходимо знать, как изменяются с температурой и давлением величины L, V1 и V2, что представляет сложную задачу. Обычно эту зависимость устанавливают эмпирически и решают К. — К. у. численно.
К. — К. у. применимо как к чистым веществам, так и к растворам и отдельным компонентам растворов. В последнем случае К. — К. у. связывает парциальное давление насыщенного пара данного компонента с его парциальной теплотой испарения.
24. Фазовое равновесие: твердое кристаллическое тело — жидкость.
ФАЗОВОЕ РАВНОВЕСИЕ, сосуществование термодинамические равновесных фаз гетерогенной системы. Является одним из основных случаев термодинамического равновесия и включает в себя условия равенства т-ры всех частей системы (термич. равновесие), равенства давления во всем объеме системы (мех. равновесие) и равенство хим. потенциалов каждого компонента во всех фазах системы, что обеспечивает равновесное распределение компонентов между фазами. Число фаз f, находящихся одновременно в равновесии, связано с числом компонентов k, числом n независимых параметров, определяющих состояние системы (обычно, когда учитывается только влияние т-ры и давления, n = 2), и числом термодинамич. степеней свободы v ур-нием: v = k + 2 - f (см. Фаз правило).[Равновесие процесса перехода в-ва из одной фазы в другую без изменения хим. состава – фаз. равновесие]
В общем виде условие Ф. р., согласно принципу равновесия Гиббса, сводится к максимуму энтропии S системы при постоянстве внутр. энергии U, общего объема V и числа молей каждого компонента ni-. Этот принцип можно выразить также как условие минимума любого из термодинамич. потенциалов: внутр. энергии U, энтальпии H, энергии Гиббса G, энергии Гельмгольца А при условии постоянства соответствующих параметров состояния, включая число молей каждого компонента. Ф.р. могут быть стабильными и метастабильными.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Твердое кристаллическое тело  Жидкость; Вэтом случае изменения объема и
Жидкость; Вэтом случае изменения объема и
| энтальпии: |

| По уравнению Клапейрона-Клаузиуса: |

Как правило, объем жидкости превышает объем твердого тела:

Ввыражении (1)  - величина большая, поэтому
- величина большая, поэтому  , но величина малая.
, но величина малая.
Для каждого вещества существует свой барический коэффициент температуры плавления.

Например, для бензола Δ T/Δ P=0.00285 K/атм. Это значит, что если твердый бензол сжать до давления в 1000 атм., то температура плавления изменится на 2, 85 К.
25. Фазовое равновесие: жидкость — пар.
 - уравнение Клайперона-Клаузиуса.
- уравнение Клайперона-Клаузиуса.
Соответственно  неизвестны для химической термодинамики, известно лишь изменение энтальпии
неизвестны для химической термодинамики, известно лишь изменение энтальпии  Определим зависимость давления насыщенного пара от температуры
Определим зависимость давления насыщенного пара от температуры  . Примем три допущения для решения уравнения Клаузиуса-Клапейрона:
. Примем три допущения для решения уравнения Клаузиуса-Клапейрона: 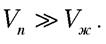 Это легко показать: 1 моль
Это легко показать: 1 моль  весит 18 г, а занимает объем V = 22, 4 л. 2) В узком температурном интервале тепловой эффект испарения Δ Нисп не зависит от температуры. 3) Считаем пар идеальным газом, для 1 моля которого выполняется закон Менделеева-Клапейрона
весит 18 г, а занимает объем V = 22, 4 л. 2) В узком температурном интервале тепловой эффект испарения Δ Нисп не зависит от температуры. 3) Считаем пар идеальным газом, для 1 моля которого выполняется закон Менделеева-Клапейрона  Тогда, учитывая допущения, уравнение Клаузиуса-Клайперона примет вид:
Тогда, учитывая допущения, уравнение Клаузиуса-Клайперона примет вид:

разделим переменные:

|
рисунок 2
Давление насыщенного пара над жидкостью не зависит от количества жидкости и определяется только температурой. Значения давления насыщенного пара для различных жидкостей сведены в таблицы. Кипение - это процесс парообразования (испарения) по всему объему жидкости, а не только с ее поверхности. Кипение имеет место, когда P н.п = Р внеш. (рис 1)
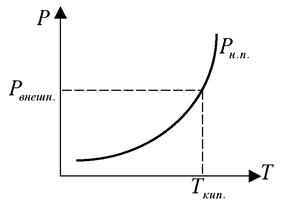

рис 1 рис 2
26.Фазовое равновесие: твердое тело — пар.

Процесс (1) называется сублимация или возгонка. А процесс (2) — конденсация. Для многих твердых веществ давление насыщенного пара очень мало. Основное условие измерения давления насыщенного пара твердого тела: в системе должно быть только твердое тело и его пар.
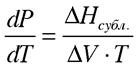 - уравнение Клапейрона-Клаузиуса для данного случая.
- уравнение Клапейрона-Клаузиуса для данного случая.
П о закону Гесса: Δ Н су 6 л =Δ Нплавл + Δ Нисп, — данное равенство соблюдается точно, когда в равновесии находятся все три фазы. Примем три допущения для решения уравнения Клаузиуса-Клайперона:
4) 
5)В узком температурном интервале тепловой эффект испарения  не зависит от температуры;
не зависит от температуры;
6) Считаем пар идеальным газом, для 1 моля которого выполняется закон Менделеева-Клайперона 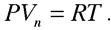 Тогда, учитывая допущения, уравнение Клаузиуса-Клайперона примет вид:
Тогда, учитывая допущения, уравнение Клаузиуса-Клайперона примет вид:

Таким образом экспериментально можно определить теплоту сублимации. разделим переменные:


27. Правило фаз Гиббса. Диаграмма состояния однокомпонентной системы .
Компонентом называется химически однородная составная часть вещества, которая может быть выведена из системы. Диаграммами состояния (фазовыми диаграммами) называются диаграммы, по которым можно определить условия устойчивости фаз и фазового равновесия. В качестве примера диаграммы состояния однокомпонентной системы рассмотрим диаграмму состояния воды. Каждая точка поля диаграммы состояний характеризуется парой чисел P и Т. AO - зависимость давления насыщенного пара твердого тела от температуры  OD - зависимость
OD - зависимость 
OB - 
AO - равновесие тв.тело  пар
пар
OD - равновесие жидкость  пар
пар
OB - равновесие тв.тело  жидкость
жидкость

В о всех других точках диаграммы состояний, которые не лежат на перечисленных
кривых, система существует в виде одной фазы. В точке О в равновесии существуют все три фазы. Эта точка называется тройной. Обозначим через Ф - число фаз системы. Пусть / - число степеней свободы, то есть число параметров, которые можно менять, не меняя состояния системы. К - число независимых компонентов системы. Также через п обозначим число внешних условий, влияющих на равновесие (как правило, давление и температура, т.е. п = 2). Правило фаз Гиббса: 
|
|
