
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лекция 6
|
|
1. Строение коллоидной частицы. Потенциалы ДЭС.
2. Влияние электролитов на строение двойного электрического слоя. Изоэлектрическое состояние. Перезарядка золей.
3. Теории строения двойного электрического слоя.
4. Электрокинетические явления. Электрофорез и электроосмос.
Строение коллоидной частицы.
По общепринятой теории мицеллярного строения коллоидных растворов коллоидная система состоит из двух частей: мицелл и интермицеллярной жидкости.
Мицелла- это структурная коллоидная единица, т.е. частица дисперсной фазы, окруженная двойным электрическим слоем.
Интермицеллярной ( межмицеллярной) жидкостью называют дисперсионную среду, разделяюшую мицеллы, в которой растворены электролиты, неэлектролиты и ПАВ, стабилизирующие коллоидную систему.
Коллоидная частица имеет сложную структуру и ее строение зависит от условий получения коллоидного раствора.
В рассматриваемой выше реакции между иодидом калия и нитратом серебра допустим, что коллоидный раствор иодида серебра AgI мы получали при условии избытка иодида калия KJ, тогда коллоидная частица будет построена следующим образом:
основу коллоидной частицы составят труднорастворимые микрокристаллы иодида серебра AgI, они состоят из m молекул AgI, эти микрокристаллы называют агрегатами,
агрегат адсорбирует на своей поверхности избыточные ионы иода, способные достроить его кристаллическую решетку, - потенциалобразующие ионы (ПОИ). Агрегат вместе с потенциалобразующими ионами составляет ядро или гранулу коллоидной мицеллы,
к ядру за счет электростатических сил притягиваются противоположно заряженные ионы, находящиеся в растворе в избытке – ионы К+, - противоионы, причем часть, которая находится в слое жидкости, смачивающем ядро, испытывает на себе действие еще и Ван-дер-Ваальсовых сил, поэтому закреплена у ядра прочно и образует так называемый адсорбционный слой противоионов,
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
а остальное количество, связанное с ядром только электростатически, располагается в жидкой фазе более размыто, т.е. диффузно, и поэтому носит название диффузного слоя.
Все это образование в целом называется мицеллой. Мицелла имеет свою структурную формулу:
{ m [AgJ] n J- (n-x)K+ }х- xK+
где m – число молекул, входящих в состав агрегата
n – число потенциалобразующих ионов,
n-x – число противоионов адсорбционного слоя,
х – количество противоионов в диффузном слое.
Мицелла золя в целом электронейтральна, а частица имеет заряд, знак которого определяет потенциалопределяющий ион.
Граница между коллоидной частицей и диффузным слоем носит название границы или поверхности скольжения, в формуле ей соответствует фигурная скобка.
Граница скольжения представляет собой геометрическую поверхность, по которой происходит свободное движение противоионов в случае наложения электрического поля на систему или перемещения мицеллы под действием сил броуновского движения.
Пример1. Изобразите схему и напишите формулу мицеллы гидрозоля сульфида ртути (II). Стабилизатор - cульфид натрия (Na2S).
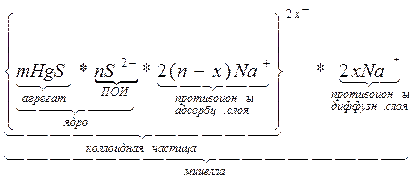
Схематично представить строение мицеллы можно так: 
Ядро мицеллы представлено агрегатом из молекул сульфида ртути  и потенциалопределяющими ионами (ПОИ) серы, а ионы натрия, находящиеся на расстоянии ионного радиуса от ядра, являются противоионами адсорбционного слоя и входят в состав коллоидной частицы., остальные же ионы натрия, связанные с коллоидной частицей только силами электростатики, образуют диффузный слой ДЭС.
и потенциалопределяющими ионами (ПОИ) серы, а ионы натрия, находящиеся на расстоянии ионного радиуса от ядра, являются противоионами адсорбционного слоя и входят в состав коллоидной частицы., остальные же ионы натрия, связанные с коллоидной частицей только силами электростатики, образуют диффузный слой ДЭС.
Потенциалы ДЭС.
Образование двойного электрического слоя приводит к возникновению электрических потенциалов на границе раздела твердой и жидкой фаз.
Это поверхностный потенциал j, - на границе внутренней обкладки двойного электрического слоя, или j - потенциал, знак его совпадает с зарядом потенциалобразующих ионов, а величина – пропорциональна числу зарядов этих ионов на поверхности частицы.
Так как его величина буде зависеть исключительно от концентрации ионов в растворе электролита, его можно посчитать по уравнению Нернста:
j = RT/Fz ln a0 /ap
где а 0 и ар - активности ионов на поверхности и в растворе соответственно, F – число Фарадея, равное NA e (е – заряд электрона),
z – заряд потенциалобразующих ионов.
С точки зрения термодинамики, j -потенциал равен работе, которую нужно совершить для переноса заряда из бесконечно удаленной точки раствора на поверхность твердой фазы, т.е. это потенциал твердой поверхности.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Электрический потенциал коллоидной частицы равен алгебраической сумме зарядов потенциалобразующих ионов и противоионов адсорбционного слоя.
Этот второй потенциал, характеризующий двойной слой, называют электрокинетическим, или x-потенциалом, так как он возникает междучастицей, способной к движению в электрическом поле и жидкой фазой.
x-Потенциал является потенциалом поверхности скольжения и термодинамически представляет собой работу, которую надо совершить для переноса единичного заряда из бесконечно удаленной точки раствора на поверхность скольжения.
Электрокинетический потенциал является частью j -потенциала и всегда меньше, чем j -потенциал.
Величина x-потенциала зависит от числа противоионов диффузного слоя и повышается с увеличением их числа.
Можно сказать, что с увеличением толщины диффузного слоя x-потенциал повышается.
Поскольку электрокинетический потенциал относится к коллоидной частице и обуславливает ее движение в электрическом поле, его можно измерить экспериментально по скорости движения коллоидных частиц.
Направление перемещения частиц дисперсной фазы к катоду или аноду укажет на знак x-потенциала.
Благодаря наличию x-потенциала на границе скольжения всех коллоидных частиц создается поле взаимного их отталкивания, препятствующее их слипанию.
2.Влияние электролитов на строение двойного электрического слоя
По отношению к каждому золю электролиты можно подразделить на индифферентные и неиндифферентные.
Индифферентные электролиты не содержат в себе ионы, способные избирательно адсорбироваться на поверхности коллоидных частиц.
Неиндифферентные содержат в себе ионы, способные избирательно адсорбироваться.
Если в коллоидный раствор ввести индифферентный электролит, то возникают следующие два явления:
1). Ионный обмен между ионами электролита и противоионами ДЭС и
2). Сжатие диффузного слоя вокруг поверхности частиц.
Например, если в иодид серебра AgJ (пример нашего золя) c отрицательно заряженными частицами ввести индифферентный электролит NaNO3, то между ионами калия и натрия может происходить ионный обмен, так как они оба могут взаимодействовать с потенциалобразующими ионами иода.
Диффузный слой содержит и те и другие ионы. Прибавление электролита увеличивает ионную силу раствора, что в свою очередь вызывает утоньшение ионной атмосферы и следовательно, уменьшение диффузного слоя. При этом некоторое число ионов переходит из диффузного слоя в адсорбционный. Следствием такого перераспределения ионов является снижение x-потенциала, в то время как величина фи-потенциала остается неизменной. И наконец может наступить такое состояние системы, когда x-потенциал примет нулевое значение. Состояние, при котором x-потенциал становится равен 0, называется изоэлектрическим состоянием.
Отрицательный логарифм концентрации потенциалопределяющего иона в растворе, при которой суммарный электрический заряд на поверхности равен нулю, называется изоэлектрической точкой (ИЭТ).
ИЭТ+ = - lg c+ или ИЭТ- = - lg –с-
где с+ и с- - концентрации потенциалопределяющих ионов в растворе, находящемся в равновесии с малорастворимым электролитом при одинаковом числе положительных и отрицательных зарядов на поверхности.
Система в этом состоянии не проявляет электрокинетических свойств.
Влияние электролитов усиливаетя, если их растворы содержат многозарядные ионы.
Многозарядный катион активнее взаимодействует с отрицательными зарядами ионов J, не только заменяя их в диффузном слое, но и вытесняя из адсорбционного и диффузного слоя в раствор.
Установлено, что электролиты, содержащие ион с зарядом 3, 4 могут не только снизить x-потенциал до нулевого значения, но и перезарядить коллоидную частицу. Это явление называют перезарядкой золя.
Суть его в следующем. Если в раствор AgJ ввести трехзарядный ион Al, то ионы алюминия вначале войдут в наружную обкладку ДЭС наравне с ионами калия.
Затем, так как их адсорбирующая способность выше (знак заряда >), активный многозарядный ион Al +3 входит в адсорбционный слой в так называемом сверхэквивалентном количестве, получается как бы сверхэквивалентная адсорбция, при которой не все заряды ионов алюминия компенсируются зарядами потенциалопределяющего иода.
Нескомпенсированные заряды придают поверхности противоположный по знаку потенциал. При этом роль потенциалобразующих уже принадлежит ионам алюминия. В соответствии с условием электронейтральности формируется новый слой противоинов из ионов другого знака заряда.
Перезарядка золей играет большую роль при исследовании зон устойчивости и зон коагуляции коллоидных систем.
Многозарядные катионы перезаряжают отрицательные золи, многозарядные анионы – положительные золи. Явление перезарядки могут вызвать большие органические ионы, такие как алкалоиды и т.п.
Введение неиндифферентных электролитов, т.е. содержащих ионы, способные достраивать кристаллическую решетку дисперсной фазы, влияет на величину j -потенциала, увеличивая его за счет потенциалопределяющего иона этого электролита, а ион, заряд которого совпадает с зарядом противоиона, сжимает двойной слой.
3. Теории строения ДЭС.
В ходе изучения двойного электрического слоя исторически сложились три теории строения двойного электрического слоя.
Первая модель была предложена Гельмгольцем, согласно которой ДЭС представлял из себя просто слой зарядов, расположенных на молекулярном расстоянии друг от друга и взаимодействующих между собой только за счет сил электростатического притяжения.
Вторая модель была выдвинута Гуи и Чепменом. Она предполагала диффузное расположение противоионов, но находящихся под действием сил, действующих в разных направлениях: электростатических сил внутренней обкладки двойного слоя и противодействующей силе теплового движения, которая приводит к размытому расположению противоионов. Они таким образом ввели понятие диффузного слоя, но не дали объяснения явлению перезарядки, так как не учитывали ряд факторов: специфическую адсорбционную способность ионов, их размер и т.д.
Третьей и обобщающей является теория Штерна, рассмотренная нами. Согласно этой теории, часть противоионов находится на молекулярном расстоянии (так называемый штерновский слой) от твердой поверхности ядра и удерживается силами Ван-дер-Вааальса и электростатическими, а часть – размыто, образуя диффузный слой.
В случае образования коллоидов неионогенными веществами, которые не способны обмениваться зарядами, образование ДЭС происходит за счет ориентации полярных молекул соприкасающихся фаз. Это имеет место при адсорбции неионогенных ПАВ или полярных молекул.
Если ДЭС образуют неполярные молекулы, то идет их поляризация в силовом поле под действием поверхностных сил.
Согласно правилу Кена, из двух сопряженных фаз положительно заряжается та, которая имеет большую диэлектрическую проницаемость. Так, при взаимодействии органических веществ с водой, отрицательно заряжается органический компонент коллоидной системы.
4.Электрокинетические явления. Электрофорез и электроосмос.
В 1807 г. профессор Московского университета Рейсс, наблюдая за коллоидными растворами открыл новое явление – передвижение коллоидных частиц в электрическом поле.
В кусок мокрой глины Рейсс погрузил две стеклянные трубки на близком расстоянии друг от друга, в которые насыпал кварцевого песка в качестве изолирующего слоя, налил воды до одинакового уровня и опустил в них металлические электроды.
Пропуская постоянный электрический ток, Рейсс заметил, что в анодной трубке жидкость над слоем песка стала мутной, появились частицы глины и уровень воды понизился.
В катодной трубке мути нет, но уровень воды повышался. Из этого опыта он сделал вывод, что частицы глины заряжены отрицательно, а вода – положительно.
Движение частиц диспергированной фазы в электрическом поле к противоположно заряженному электроду получило название электрофореза, а движение жидкой фазы относительно неподвижной дисперсионной среды – электроосмоса.
Электрофорез и электроосмос относятся к прямым электрокинетическим явлениям, так как они возникают под действием наложенного извне электрического поля.
Но электрокинетические явления могут возникнуть и при простом механическом перемещении одной фазы относительно другой вдоль поверхности раздела. Такие явления называют обратными.
В 1859г. Квинке обнаружил явление, обратное электроосмосу и названное им потенциалом протекания, которое заключалось в том, что при продавливании жидкости через полупроницаемую перегородку (пористую диафрагму) возникает разность потенциалов.
Явление, обратное электрофорезу, и названное потенциалом седиментации, было открыто Дорном в 1878г. Оказалось, что при оседании частиц кварца под действием силы тяжести в сосуде с водой, возникает разность потенциалов между разными уровнями оседания.
Все электрокинетические явления основаны на наличии двойного электрического слоя на границе раздела фаз.
Из всех явлений наибольшее значение в практике имеет электрофорез.
Во-первых, можно определить величину -потенциала по скорости передвижения частиц дисперсной фазы, которую можно измерить экспериментально, и потенциал рассчитать по уравнению Гельмгольца-Смолуховского:
x = kphu/ eC
Зная величину x-потенциала, можно судить об устойчивости золя, так как она меняется синхронно с изменением электрокинетического потенциала.
Электрофорез применяют для биоанализа ферментов, вакцин, крови, очистки лекарственных препаратов. Он является одним из методов введения лечебных препаратов в организм человека.
Электроосмос применяют в процессах обезвоживания и сушки многих пористых материалов. Суть этого процесса в следующем: подлежащую осушке кашицеобразную массу помещают между двумя электрофильтрами-прессами, в одном из которых (нижнем) имеются отверстия, т.е. она префорирована. Затем на эти металлические пластины подают заряд: на верхнюю – одноименный с зарядом водной фазы, а на нижнюю – противоположный жидкой фазе. Поэтому жидкость устремляется книжнему электроду и удаляется через перфорированную поверхность электрофильтра.
| ЛЕКЦИЯ 7 1. Методы получения и очистки дисперсных систем. 2. Агрегативная устойчивость и коагуляция дисперсных систем. Термодинамические и кинетические факторы устойчивости. 3. Коагуляция электролитами. Кинетика коагуляции. 4. Стабилизация дисперсных систем Методы получения и очистки дисперсных систем. Из классификации дисперсных систем следует, что коллоидные системы занимают промежуточное положение между грубодисперсными и молекулярнымирастворами, это определяет два пути их получения: путь укрупнения частиц при агрегации молекул - этот метод называют конденсационным; и второй путь – путь измельчения крупных частиц до коллоидных размеров – этот метод называют диспергированием. Конденсационный метод может быть по механизмупротекания химическим и физическим. Но и тот и другой метод сводится к образованию в гомогеннойсреде новой фазы, имеющей коллоидную дисперсность. Физическая конденсация представляет собой пересыщение раствора или пара. При возникновении местных пересыщений в каких-то участках раствора создаются агрегаты из нескольких молекул, это - зародыши новой фазы, так называемые центры кристаллизации – их роль могут выполнять вносимые в раствор пылинки, или небольшие добавки готового золя. К методам физической конденсации относится не только пересыщение растворов, но и метод замены растворителя. Он основан на том, что раствор вещества медленно понемногу добавляют к жидкости, с которой хорошо смешивается растворитель, но в которой растворенное в нем вещество мало или совсем нерастворимо. Поясним на примере. Если растворенную в спирте канифоль влить в воду, моментально образуется коллоидный раствор канифоли в воде. также ведут себя спиртовые растворы серы, холестерина. Другой метод физической конденсации состоит в конденсации паров, при пропускании паров простого вещества через жидкость в результате конденсации происходит образование стойкого золя. Так например, на этом основаны электрические методы получения золей металлов – их распыляют под водой или в органической жидкости в вольтовой дуге (метод Бредига) и в высокочастотном искровом разряде (метод Сведберга). Самым обычным примером физической конденсации в природе является образование туманов и облаков при конденсации водяных паров в атмосфере. Химическая конденсация – это возникновение новой фазы путем получения малорастворимых или нерастворимых соединений в результате химической реакции. Этими реакциями могут быть реакции окисления, восстановления, двойного обмена, гидоролиза. Как правило, высокодисперсные золи получают путем медленного добавления концентрированного раствора одного из реагентов в разбавленный раствор другого. При такой методике разбавленный раствор быстро истощается, образуя кристаллы новой фазы. Метод диспергирования - это метод измельчения твердых материалов или жидкостей и распределение их частиц в жидкой или газообразной среде, в результате чего образуются порошки, суспензии, эмульсии, пены. Методы измельчения крупных образований до коллоидного состояния делят на механические, физические и физико-химические. К механическим относят грубое, среднее и мелкое дробление. В основу действия механизмов для дробления положены принципы раздавливания, раскалывания, истирания, удара и т.д. Тонкий и сверхтонкий помол производят в так называемых коллоидных мельницах, состоящих из статора и ротора с узким зазором между ними и высокой частотой оборота – до 20 000 об/мин. Для повышения дисперсности эмульсийприменяют гомогенизаторы– суть его действия заключается в продавливании эмульсий через узкие каналы и щели под большим давлением. Примером использования физического дробления является ультразвуковое диспергирование – таким методом можно разбить не только жидкости до мельчайших капель, но и твердые вещества. Таким путем получают эмульсии и суспензии. Более того, при действии ультразвуком на коллоидные растворы и эмульсии происходит их стерилизация, так как кавитация вызывает разрушение микроорганизмов и их спор. Физико-химическое диспергирование или пептизация, заключается в обработке свежего осадка пептизатором: раствором электролита, ПАВ, или растворителя. Под понятием свежий осадок понимается рыхлый осадок, независимо от времени его существования, так как в рыхлом осадке имеются прослойки дисперсионной среды между частицами, а слежавшиеся осадки не поддаются диспергированию. Различают три вида пептизации: 1) адсорбционная пептизация, 2) диссолюционная (или химическая) пептизация, 3) промывание осадка растворителем (дисперсионной средой). 1).Реакция между желтой кровяной солью и хлоридом железа ведет к образованию осадка берлинской лазури: Причем, если мы проведем реакцию в строго эквивалентных количествах реагентов, т.е. согласно стехиометрическим коэффициентам, то получим просто осадок, на частицах которого отсутствует ДЭС, так как в системе отсутствуют ионы, способные избирательно адсорбироваться на его поверхности. Для того, чтобы произошла пептизация, необходимо этот слой создать. Условием такого выхода является добавление готового гексаферроцианида калия или хлорида железа к полученному осадку. 2).При диссолюционной пептизации ДЭС создается за счет обработки поверхности осадка растворителем, чтобы создать небольшое количество электролита, который вызовет адсорбционную пептизацию. Например, для образования иона-пептизатора для золя гидроксида железа следует осадок его растворить небольшим количеством НCl конц. Образовавшийся оксихлорид FeOCl диссоциирует на ионы FeO и Cl и служит пептизатором. При этом способе пептизации важно, чтобы количество растворителя было небольшим, иначе весь осадок перейдет в молекулярный раствор. 3). Пептизации путем промывания растворителем п одвергают осадки, которые были получены при большом избытке одного из реагентов. В этом случае на осадке имеется ДЭС, но он сильно сжат за счет высокой концентрации электролита. Чтобы кулоновские силы отталкивания начали действовать, следует снизить его концентрацию, что достигается промыванием осадка на фильтре. Через фильтр пройдет устойчивый золь. Метод очистки коллоидных растворов Получая коллоидные растворы практически невозможно сделать так, чтобы раствор не содержал в себе излишки электролита, что снижает его устойчивость. Поэтому возникает необходимость очистить коллоидную систему от этого излишка. Очистку коллоидных растворов проводят либо методом диализа, либо методом ультрафильтрации. Диализ – это извлечение из золей низкомолекулярных веществ чистым растворителем с помощью полупроницаемой перегородки (мембраны), через которую не проходят коллоидные частицы. Периодически меняя растворитель в диализаторе можно практически удалить примеси электролита и низкомолекулярных соединений. Недостатком метода является большая длительность процесса – недели, месяцы. Ускорить процесс можно, применив электрический ток. Это т процесс называется электродиализом. Простейший электродиализатор представляет собой сосуд, разделенный двумя мембранами на три камеры. В среднюю камеру наливают подлежащий очистке раствор. В боковые камеры – электроды и обеспечивают подвод и отвод растворителя. Под действием электрического поля происходит пренос катионов из средней камеры в катодную камеру, анионов – в анодную. Раствор в средней камере может быть очищен от электролита в течение нескольких минут. Ультрафильтрация – это диализ, проводящийся под давлением. При этом через полупроницаемую мембрану проходит дисперсионная среда вместе с растворенными в ней низкомолекулярными соединениями. Таким образом получают межмицеллярную жидкость. 2. Агрегативная устойчивость и коагуляция дисперсных систем. Термодинамические и кинетические факторы устойчивости Получение и использование многих ценных материалов и продуктов возможно только при условии получения устойчивых коллоидных систем. Поскольку большинство лиофобныхзолей являются термодинамически нестабильными дисперсными системами и склонны к процессу коагуляции. Коагуляцией называют процесс слипания (или слияния) частиц дисперсной фазы. Русский ученый Н.П. Песков (1920) ввел понятие о двух видах устойчивости коллоидных систем: седиментационной и агрегативной. Седиментационной или кинетической называют способность системы противостоять силам тяжести и процессу оседания частиц или их всплывания. Агрегативная устойчивость – это способность системы противостоять силам агрегации (слипания). В этом отношении системы делят на два класса – коллоиды, которые самопроизвольно диспергируются и существуют без дополнительной стабилизации – это лиофильные золи например, растворы ПАВ, ВМВ, при образовании этих систем свободная энергия Гиббса системы уменьшается, т. е. их образование термодинамически выгодно систсме DG < 0; и 2) термодинамически неустойчивые системы, у них DG > 0. К ним относятся эмульсии, суспензии, золи.Наиболее неустойчивыми коллоидными системами являются гидрофобные золи, у которых наблюдается слабое взаимодействие между фазой и средой. Для приданиятаким системам устойчивости необходимо присутствие так называемых факторов устойчивости. Факторы агрегативной устойчивости подразделяют на термодинамические и кинетические. К термодинамическим факторам относятся: 1.) Электростатический – способствует созданию электростатических сил отталкивания. Это обеспечивается большой величиной фи-потенциала или дзета-потенциала. 2.) Адсорбционно-сольватный – это фактор, приводящий к снижению межфазного натяжения и снижению поверхностной энергии Гиббса. 3.) Энтропийный фактор – условие, обеспечивающее равномерное распределение частиц по всему объему системы (броуновское движение) Кинетические факторы устойчивости – факторы, снижающие скорость агрегации частиц дисперсной фазы. К ним относятся: 1). Структурно-механический – образование на поверхности частицы защитных слоев (пленок), обладающих упругостью и механической прочностью. 2). гидродинамический – снижает скорость агрегации вследствие изменения вязкости среды, плотности дисперсной фазы и дисперсионной среды. В реальных системах агрегативная устойчивость обычно обеспечивается сразу несколькими факторами. При этом двафактора имеют решающее значение: это электростатический барьер, т. е. наличие барьера, препятствующего слипанию частиц и адсорбционно-сольватный – барьер, окружающий частицу и механически препятствующий ее сближению с другими частицами. |
Дерягиным Б.П., Ландау Л.Д. (1937) Э. Фервеем и Я. Овербеком (1941) была разработана современная теория устойчивости гидрофобных дисперсных систем, описывающая их поведение в зависимости от действия того или оиного фактора устойчивости --по первым буквам фамилий авторов она названа теорией ДЛФО.
Согласно этой теории, между любыми частицами при их сближении возникает расклинивающее давление разделяющей их жидкой прослойки в результате взаимодействия сил притяжения и отталкивания. Состояние системы зависит от баланса энергии притяжения и энергии отталкивания.
Если на оси абсцисс отложить расстояние между молекулами, а по оси ординат – энергию отталкивания вверх как положительную и энергию притяжения – вниз как отрицательную, то получаем две кривых 1 и 2:
 |
Суммарную энергию взаимодействия в зависимости от расстояния получаем в виде кривой 3 при сложении кривых 1 и 2. Кривая 3 и есть энергия расклинивающего давления, или результирующая потенциальная кривая.
Природа сил притяжения и сил отталкивания различна, поэтому и кривые 1 и 2 имеют неодинаковый характер. Силы отталкивания имеют электростатический характер (ДЭС) и по теории ДЛФО изменяются при расхождении молекул по экспоненциальному закону,
а силы притяжения обусловлены силами межмолекулярного взаимодействия Ван-дер-Ваальса, они убывают пропорционально квадрату расстояния между частицами, и поэтому знак суммарной энергии расклинивающего давления будет зависеть от преобладания тех или иных сил.
Из графика видно, что результирующая потенциальная кривая имеет три характерных участка: 1 – минимум расстояния между молекулами, соответствует их слипанию, где сильны силы электростатического взаимодействия - это так называемая первая потенциальная яма, далее следует участок, где силы отталкивания преобладают над силами притяжения, это зона устойчивости золя, ей характерны средние расстояния между молекулами, обусловленные радиусами ионных оболочек (около 100 нм), кривая лежит над осью абсцисс, образуя энергетический барьер DU. Величина DU тесно связана с агрегативной устойчивостью золя.
И третья зона кривой – где силы притяжения преобладают над силами отталкивания, это зона дальнего действия сил притяжения называется вторичным потенциальным минимумом.
Частицы дисперсной фазы обладают определенной кинетической энергией, - kT за счет которой они могут сближаться и расходиться. В зависимости от высоты энергетического барьера и глубины потенциальных ям может быть три варианта поведения золя:
1. DU > > kT - и отсутствует вторичный минимум. Частицы не могут преодолеть барьер и расходятся, не взаимодействуя. В этом случае система агрегативно устойчива.
2. Малая высота барьера и неглубокий вторичный потенциальный минимум, в этом случае DU £ kT и тепловое движение может сблизить молекулы на расстояние, что они попадут в первую потенциальную яму, при этом они слипнутся. Наступит коагуляция.
3. Умеренно глубокий вторичный потенциальный минимум и достаточно высокий энергетический барьер DU ==(5-10) kT. В этом случае имеет место дальнее взаимодействие двух частиц, при котором частицы не могут разойтись, так как этому препятствуют силы притяжения, но и не могут приблизиться вплотную, так как этому препятствует силы отталкивания. При таких условиях образуются структурированные мицеллы – гели, в которых сохраняется прослойка дисперсионной среды между частицами.
Этим объясняется такое явление, как тиксотропия ( тиксис – встряхивание, тропос – изменение). Оно заключается в следующем: многие золи и гели при простом механическом встряхивании способны разжижаться, т. е. переходить в золи или растворы полимеров, а затем, при хранении в покое, снова образовывать гель или студень. Если вновь полученный гель или студень опять перемешать, он снова перейдет в состояние раствора или золя, а потом через некоторое время опять застудневает. Такое повторное разрушение и образование золя идет изотермически. (Значение тиксотропии в технике и практике самостоятельно).
Таким образом, теория ДЛФО полностью объясняет поведение гидрофобных золей.
Если частицы имеют высокий электрический потенциал и достаточной толщины диффузный слой, то при перекрывании их ДЭС не происходит взаимодействия и частицы расходятся. Система является агрегативно устойчивой.
Сжатие диффузного слоя приведет к преобладанию сил притяжения над силами отталкивания и частицы слипнутся.
Сжатие диффузного слоя может происходить при добавлении к системе электролитов. При этом согласно теории ДЛФО, возможны два механизма коагуляции: концентрационная и нейтрализационная.
Концентрационная коагуляция наступает при введении в коллоидную систему индифферентного электролита. Добавление такого электролита не меняет величину фи-потенциала во внутренней обкладке двойного слоя, при этом коагуляцию вызывает сжатие двойного слоя за счет проталкивания части противоионов из диффузного слоя в адсорбционный, которые компенсируют дзета-потенциал.
Нейтрализационная (адсорбционная) коагуляция вызывается добавлением неиндифферентного электролита, содержащего заряженный противоположно частице ион, способный специфически адсорбироваться на поверхности частицы и при этом идет снижение фи-потенциала и как следствие, одновременное снижение дзета-потенциала.
Например, в нашей реакции получения Ag J с положительно заряженными частицами (ПОИ - Ag) коагуляцию может вызвать чрезмерное добавление KJ.
Наблюдения Г.Шульце показали, что коагулирующая способность иона-коагулятора возрастает с увеличением его заряда.
М.Гарди показал, что заряд иона-коагулятора всегда противоположен заряду коллоидной частицы.
Это правило известно как правило Шульце-Гарди:
Коагулирующим действием обладает тот ион электролита, заряд которого противоположен заряду гранулы, коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора.
Минимальное значение концентрации, при которой данный электролит вызывает коагуляцию, называют порогом коагуляции (моль/л или ммоль/л).
Величину, обратную порогу коагуляции называют коагулирующей способностью и обозначают Vк:
Vк = 1/с, (л/моль)
коагулирующая способность выражает число объемов золя, скоагулированных 1 молем иона-коагулятора.
По правилу Шульце для порогов коагуляции ионов можно записать такой ряд, который был теоретически обоснован Дерягиным и Ландау: (закон 6-ой степени)
СI: СII: СIII = 1: 1/26: 1/36
Ход коагуляции в зависимости от концентрации коагулирующего электролита можно разделить на две стадии: медленную и быструю.
При быстрой коагуляции каждое столковение коллоидных частиц приводит к их слиянию, и скорость коагуляции не зависит от концентрации электролита.
Медленная коагуляция зависит от концентрации коагулирующего электролита.
Эта зависимость может быть отражена следующим графиком:
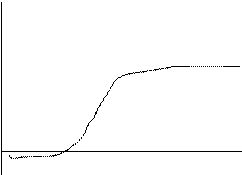 |
Три области графика определяют зоны устойчивости золя. ОА – золь устойчив, концентрация добавленного электролита мала и не влияет на свойства золя.
АБ – зона медленной коагуляции, когда при постепенном увеличении концентраци электролита идет резкое увеличение скорости коагуляции;
и БС – зона быстрой коагуляции, где концентрация электролита уже не влияет на скорость коагуляции.
Точка А на этом графике показывает ту критическую концентрацию, при которой начинается коагуляция и представляет собой порог коагуляции, т. е. минимальную концетрацию электролита, при которой начинается коагуляция золя данным электролитом.
А точка Б – критическую концентрацию, после которой концентрация электролита уже не влияет на скорость коагуляции золя. Это значение концентрации принято называть порогом быстрой коагуляции.
Быстрая коагуляция происходит при полном исчезновении потенциального барьера, т.е. когда DU ==0.
Кинетика коагуляции была изучена польским ученым М.Смолуховским. (1916). Рассматривая коагуляцию как реакцию второго порядка, в элементарном акте которой участвуют две частицы, Смолуховский вывел уравнение:
 ,
,
где q - время за которое число частиц сократится вдвое, т.е. время половинной коагуляции,
К – константа скорости быстрой коагуляции, п0 – первоначальное число частиц. Принимая, что потенциальный барьер равен 0, т.е. каждое столкновение заканчивается слипанием, теория дает для К простую формулу:
К = ¾ kТ/3h,
где h - вязкость среды, k – константа Больцмана.
Стабилизация дисперсных систем. Коллоидная защита.
Устойчивость лиофобных золей против коагуляции возрастает в присутствии ВМВ: белков, полисахаридов (альбумина, желатина, казеина, крахмала, пектина, каучука ит.д.). Сами эти вещества дают лиофильные коллоидные растворы и поэтому явление стабилизации золя с их помощью носит название коллоидной защиты.
Механизм их защитного действия можно объяснить тем, что макромолекулы адсорбируются на поверхности коллоидных частиц и создают адсорбционно-сольватные слои, повышая гидрофильность частиц. Вследствие этого усиливается взаимодействие частица – растворитель.
Сольватные слои обеспечивают большое расклинивающее давление между частицами дисперсной фазы и препятствуют их слипанию.
Способность защищать золь от коагуляции выражается защитным числом, равным количеству мг сухого ВМВ, защищающего 10 мл золя от коагуляции при действии на него 1 мл 10% раствора NaCl.
В зависимости от золя, который надо защитить, число это называют золотым, если это золь золота, железным, если это золь железа, серебрянным и т.д.
Очевидно, что чем больше это число, тем хуже ВМВ защищает золь от коагуляции.
Значение коллоидной защиты очень велико. Коллоидная защита применяется для приготовления золей, которые должны быть устойчивы длительное время. Это лекарства, косметические и некоторые пищевые продукты. Колларгол, например, защищен желатином. Белки крови защищают капельки жира и холестерин и другие гидрофобные вещества от коагуляции.
Ослабление защитных функций белков приводит к отложению холестерина на стенках сосудов, образованию камней в почках, печени и т.д.
|
|
