
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Химическая адсорбция, или хемосорбция.
|
|
Хемосорбция – это адсорбция, которая протекает под действием силосновных валентностей.
Она специфична и зависит от природы адсорбента и адсорбтива и по существу представляет собой поверхностную химическую реакцию адсорбата и адсорбтива.
Экспериментально физическую адсорбцию от химической можно отличить по теплоте адсорбционного процесса.
Энергия образования связи адсорбент-адсорбтив при хемосорбции очень велика и приблизительно равна энергии образования химических соединений. Для сравнения: теплоты физической адсорбции составляют 8- 20 кДж/моль, а химической адсорбции 80- 800 кДж/моль.
С повышением температуры хемосорбция возрастает, согласно теории химической кинетики. Она почти всегда необратима и приводит к образованию прочных поверхностных соединений между адсорбентом и адсорбтивом или к распространению химической реакции между адсорбентом и адсорбтивом по всему объему системы, например, адсорбция СО2 оксидом кальция или взаимодействие кислорода воздуха с медью.
В зависимости от агрегатного состояния сосуществующих фаз различают следующиие виды адсорбции:
· адсорбция на границе раздела газ-жидкость
· адсорбция на границе раздела жидкость-жидкость
· адсорбция на границе раздела твердое тело-газ
· адсорбция на границе раздела твердое тело-жидкость
Для количественной характеристики адсорбции используют две величины:
Количество вещества, адсорбированнго единицей массы адсорбента называют абсолютной адсорбцией и обозначают А (моль/г)
Избыток или недостаток растворенного вещества в поверхностном слое, отнесенный к единице поверхности, называют Гиббсовской адсорбцией и обозначают Г (моль/м2, кг/м2)
2. Адсорбция на границе раздела газ-жидкость и жидкость –жидкость. Фундаментальное уравнение адсорбции Гиббса. Уравнение изотермы адсорбции Гиббса
Известно, что при растворении в воде ПАВ накапливаются в поверхностном слое, ПИВ – концентрируются в объеме раствора.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
И в том, и в другом случаях распределение вещества между поверхностным слоем и внутренним объемом подчинятеся принципу минимизации энергии Гиббса: на поверхности оказывается то вещество, которое обеспечивает наименьшее поверхностное натяжение при данных условиях.
Разность концентраций создает осмотическое давление, начинается процесс диффузии, стремящийся выровнять концентрацию по всему объему. Когда уменьшение поверхностной энергии, связанное с обеднением или обогащением поверхностного слоя растворенным веществом будет уравновешено силами противодействующего осмотического давления (или когда химические потенциалы растворенных веществ в глубине объема будут равны хим. потенциалам на его поверхности):

где n – общее число молей адсорбтива,
в системе наступает подвижное равновесие, которое и характеризуется величиной Г.
Если в уравнении все величины отнести к единице поверхности, то получим:

где Г=n/S – поверхностный избыток компонента i в поверхностном слое (по сравнению с его равновесной концентрацией в объемной фазе)
Это уравнение известно как фундаментальное уравнение адсорбции Гиббса.
Простых и доступных методов прямого определения избытка растворенного вещества Г в адсорбционном слое на подвижных границах раздела фаз не существует.
Однако на поверхностях газ-жидкость и жидкость-жидкость всегда можно измерить поверхностное натяжение. Поэтому для определения адсорбции особенно важным является уравнение изотермы адсорбции Гиббса (1878).
Поскольку фундаментальное уравнение Гиббса устанавливает зависимость между поверхностным избытком растворенного вещества Г и изменением поверхностного натяжения и д ля единицы площади поверхности при постоянной температуре можно записать:
ds = -Гdm
где dm -бесконечно малое изменение химического потенциала адсорбируемого вещества, которое связано с его концентрацией (активностью) известным выражением:
m = m0 + RT ln a
то отсюда следует:
dm = RT d lna =RT da/a
Делая подстановку вместо dm и решая его относительно Г, можно написать:

При малых концентрациях адсорбирующегося вещества уравнение принимает вид:

где с – концентрация при равновесии адсорбционного слоя и газообразного или растворенного вещества в ср еде, из которой происходит адсорбция.
Если адсорбция происходит из газовой фазы, то применив уравнение Менделеева-Клапейрона
pV=nRT или p=cRT,
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
получим:

Следовательно, зная зависимость поверхностного натяжения раствора от концентрации растворенного вещества (или давления его пара) по этим уравнениям можно рассчитать изотерму адсорбции этого компонента.
В нескольких точках кривой s =f(с) проводят касательные и определяют тангенсы угла наклона к оси абсцисс, которые соответствуют значениям производных ds|dc в данных точках.
З ная эти производные, по уравнению изотермы адсорбции можно посчитать величину Г, что позволит построить изотерму адсорбции Г=f(с).
 | |||||
 | |||||
 | |||||
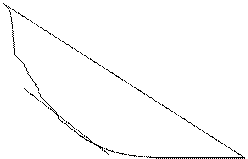
 Изотерма адсорбции для жидких поверхностей раздела, т.е. для газ-жидкость и жидкость-жидкость как правило имеет следующий вид:
Изотерма адсорбции для жидких поверхностей раздела, т.е. для газ-жидкость и жидкость-жидкость как правило имеет следующий вид:
 |
Наибольшее и постоянное значение адсорбции Г или А, при котором достигается насыщение адсорбционного слоя и адсорбция уже не зависит от концентрации, называют предельной адсорбцией Гпр или Апр.
Согласно выводу уравнения, Г представляет собой разность между концентрацией адсорбтива в поверхностном слое C2 и внутри объема C1.
Если адсорбция положительна, то при C2> C1 s2 < s1 (ds|dc)< 0, Г > 0 и концентрация адсорбтива в повехностном слое больше, чем в объеме, Это характерно для ПАВ.
При отрицательной адсорбции C1> C2, s1< s2 (ds|dc)> 0, Г < 0. Это характерно для ПИВ.
|
|
