
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Фториды серы. Оксохлориды серы (хлористый тионил, хлористый сульфурил), хлорсерная (хлорсульфоновая) кислота, их получение, строение молекул и свойства.
|
|
Фториды серы - соединения серы с фтором: SF6, SF4, S2F10, SF2, S2F2. Практическое значение имеют первые 3 соединения. Сера шестифтористая (гексафторид серы, SF6), бесцветный газ без запаха. Мало растворима в воде несколько лучше в спирте. При нагревании в кислороде или водороде не изменяется, но сероводородом разлагается на HF и S. Образуется при сжигании S во F2. Служит газообразным изолятором для высоковольтных установок (т. н. элегаз). Сера пятифтористая (S2F10) - бесцветная жидкость. По химическим свойствам похожа на SF6, но отличается меньшей инертностью и очень ядовита. С CCl2 даёт фторохлорид SF5CI. Образуется при взаимодействии элементов в качестве примеси к SF6. Сера четырёхфтористая (серы тетрафторид, SF4) - бесцветный сильно ядовитый газ с резким запахом. Получают взаимодействием SCI2 с NaF или CoF3 с S. Реагируют с альдегидами, кетонами и другими карбонильными соединениями, образуя соответствующие фторорганические соединения.
Тионилхлорид (хлористый тионил) SOCl2 — хлорангидрид сернистой кислоты. Относится к тионилгалогенидам.
Свойства.
Тионилхлорид — бесцветная дымящаяся на воздухе жидкость с удушающим запахом. Молекула тионилхлорида имеет пирамидальное строение.
При нагревании выше температуры кипения тионилхлорид начинает разлагаться с образованием S2Cl2, SO2, Cl2. Выше 440 °C наблюдается полный распад соединения.
В воде разлагается на диоксид серы и хлороводород:

Широко применяется в органическом синтезе в качестве хлорирующего агента, например, для получения хлорангидридов карбоновых кислот и алкилгалогенидов:

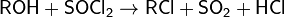
Тионилхлорид можно получить по следующим реакциям:




В промышленности тионилхлорид получают прямым взаимодействием серы, кислорода, хлора при 180—200 °C (с использованием в качестве катализатора активного угля) или действием избытка диоксида серы на тетрахлорметан в присутствии хлорида алюминия при 150 °C и давлении около 4 МПа (40 кгс/см2).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Сульфурилхлорид (хлористый сульфурил) SO2Cl2 — хлорангидрид серной кислоты.
Свойства.
Бесцветная, резко пахнущая жидкость, хорошо растворимая в хлороформе и уксусной кислоте, в избытке воды растворяется с частично протекающим гидролизом. Дымит на воздухе, гидролизуется по реакции:

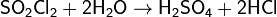
Гидролиз идёт слабо в холодной воде, в горячей воде протекает быстро.
При хранении желтеет, поскольку распадается на SO2 и зеленовато-жёлтый хлор.

Получают взаимодействием SO2 с Cl2 в присутствии катализаторов (активированный уголь, камфора).

Хлорсульфо́ новая кислота, HSO3Cl — монохлорангидрид серной кислоты, бесцветная, дымящая на воздухе и резко пахнущая жидкость.
Свойства.
Хлорсульфоновая кислота не образует солей. При взаимодействии с водой происходит бурная экзотермическая реакция с гидролизом хлорсульфоновой кислоты на серную кислоту и хлороводород:

С органическими соединениями хлорсульфоновая кислота взаимодействует, образуя, в зависимости от условий, сульфоновые кислоты или их хлориды:
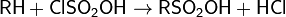

Благодаря этим реакциям, ClSO2OH широко применяется в качестве сульфурирующего агента в органической химии.
Получают хлосульфоновую кислоту непосредственно при взаимодействии хлороводорода с оксидом серы(VI):

или при взаимодействии концентрированной серной кислоты с трихлоридом или пентахлоридом фосфора:
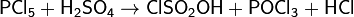 .
.
45. Водород – общая характеристика, физические и химические свойства, получение. Гидриды – получение, свойства. Водородные соединения неметаллов. Применение водорода и его соединений.
Водоро́ д — первый элемент периодической системы элементов.
Физические свойства.
Простое вещество водород — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине. Практически не растворим в серебре.
Водород — самый лёгкий газ, он легче воздуха в 14, 5 раз. Молекула водорода двухатомна — Н2.
Химические свойства.
Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
 - 432 кДж
- 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например, с кальцием, образуя гидрид кальция:

и с единственным неметаллом — фтором, образуя фтороводород:

С галогенами образует галогеноводороды:
 , реакция протекает со взрывом в темноте и при любой температуре,
, реакция протекает со взрывом в темноте и при любой температуре,
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
 , реакция протекает со взрывом, только на свету.
, реакция протекает со взрывом, только на свету.
При взаимодействии с активными металлами водород образует гидриды:


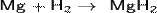
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:

Оксиды восстанавливаются до металлов:



Получение.
|
|
