
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Кислород, строение молекулы, способы получения, физические и химические свойства. Озон, его получение, свойства и применение.
|
|
Кислоро́ д — элемент 16-й группы, второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 8. Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Кислород при нормальных условиях —газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2), в связи с чем его также называют дикислород.
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
В лабораториях пользуются кислородом промышленного производства, поставляемым в стальных баллонах под давлением около 15 МПа.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:

Используют также реакцию каталитического разложения пероксида водорода Н2О2 в присутствии оксида марганца(IV):
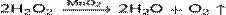
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:

К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей, а также разложение оксида ртути(II) (при t = 100 °C):

На подводных лодках обычно получается реакцией пероксида натрия и углекислого газа, выдыхаемого человеком:

Физические свойства.
Немного тяжелее воздуха. Слабо растворяется в воде и спирте. Хорошо растворяется в расплавленном серебре. Является парамагнетиком.
Жидкий кислород (температура кипения − 182, 98 °C) — это бледно-голубая жидкость.
Твёрдый кислород (температура плавления − 218, 35 °C) — синие кристаллы.
Химические свойства.
Сильный окислитель, взаимодействует со всеми элементами, кроме гелия, неона, аргона и фтора, образуя оксиды. Степень окисления − 2. Как правило, реакция окисления протекает с выделением тепла и ускоряется при повышении температуры (см. Горение). Пример реакций, протекающих при комнатной температуре:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
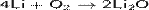

Окисляет соединения, которые содержат элементы с не максимальной степенью окисления:

Окисляет большинство органических соединений:

При определённых условиях можно провести мягкое окисление органического соединения:

Кислород реагирует непосредственно (при нормальных условиях, при нагревании и/или в присутствии катализаторов) со всеми простыми веществами, кроме Au и инертных газов (He, Ne, Ar, Kr, Xe, Rn); реакции с галогенами происходят под воздействием электрического разряда или ультрафиолета. Косвенным путём получены оксиды золота и тяжёлых инертных газов (Xe, Rn). Во всех двухэлементных соединениях кислорода с другими элементами кислород играет роль окислителя, кроме соединений со фтором.
Кислород образует пероксиды со степенью окисления атома кислорода, формально равной − 1.
Озо́ н — состоящая из трёхатомных молекул O3 аллотропная модификация кислорода. При нормальных условиях — голубой газ. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, практически чёрные кристаллы.
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария:

Образование озона проходит по обратимой реакции:
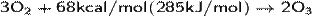
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[8]превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
В присутствии небольших количеств HNO3 озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (—78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины и иридия) до их высших степеней окисления. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон может образовывать неорганические озониды, содержащие анион O3− . Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3, и CsO3 могут быть получены из соответствующих супероксидов:
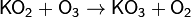
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам.
Применение озона обусловлено его свойствами:
Ø сильного окисляющего реагента:
· для стерилизации изделий медицинского назначения
· при получении многих веществ в лабораторной и промышленной практике
· для отбеливания бумаги
· для очистки масел
Ø сильного дезинфицирующего средства:
· для очистки воды и воздуха от микроорганизмов (озонирование)
· для дезинфекции помещений и одежды
· для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
|
|
