
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
В лаборатории
|
|
· Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную серную кислоту:

· Взаимодействие кальция с водой:

· Гидролиз гидридов:

· Действие щелочей на цинк или алюминий:

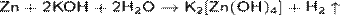
· С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:

Гидриды — соединения водорода с металлами и с имеющими меньшую электроотрицательность, чем водород, неметаллами.
Химические свойства.
Взаимодействие ионных гидридов с водой:
NaH + H2O → NaOH + H2↑
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов:
2CaO + CaH2 → 2Ca + Ca(OH)2
3ZnO + 2AlH3 → 3Zn + 2Al + 3H2O
Термическое разложение:
2LiH → 2Li + H2↑
2NaH → 2Na + H2↑
Взаимодействие с азотом:
3СаН2 + N2 → Ca3N2 + ЗН2
Ионные гидриды получают взаимодействием простых веществ:
2Na + H2 → 2NaH
С неметаллами водород образует летучие соединения молекулярного строения. В обычных условиях это газы или летучие жидкости.
1. В периодах слева направо у ионов элементов положительный заряд увеличивается. В связи с этим кислотные свойства летучих водородных соединений элементов в водных растворах усиливаются.
2. В группах сверху вниз отрицательно заряженные анионы все слабее притягивают положительно заряженные ионы водорода Н+. В связи с этим облегчается процесс отщепления ионов водорода Н+ и кислотные свойства водородных соединений увеличиваются.
3. Водородные соединения неметаллов, обладающие в водных растворах кислотными свойствами, реагируют со щелочами. Водородные же соединения неметаллов, обладающие в водных растворах основными свойствами, реагируют с кислотами.
4. Окислительная активность водородных соединений неметаллов в группах сверху вниз сильно увеличивается. Например, окислить фтор из водородного соединения HF химическим путем нельзя, окислить же хлор из водородного соединения HCl можно различными окислителями. Это объясняется тем, что в группах сверху вниз резко возрастают атомные радиусы, в связи с чем, отдача электронов облегчается.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Атомарный водород используется для атомно-водородной сварки.
|
|
