
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Полимерные кислоты фосфора. Галогениды и оксогалогениды, их получение и свойства. Применение фосфора и его соединений.
|
|
Конденсированные (полимерные) фосфорные кислоты подразделяются на полифосфорные с линейным строением фосфатаниона общей формулы Hn+2PnO3n+1, метафосфорные с циклическим строением фосфатаниона общей формулы (HPO3)n и ультрафосфорные кислоты, имеющие разветвленную, сетчатую структуру. Наибольшее практическое значение имеют полифосфорные кислоты. Из полифосфорных кислот наиболее полно изучена дифосфорная (пирофосфорная) кислота H4P2O7, выделенная в кристаллическом виде в двух формах с температурами плавления 54, 3 С и 71, 5 С. Пирофосфорная кислота четырёхосновна. Три- и тетраполифосфорные кислоты выделены в виде разбавленных растворов. Полифосфорные кислоты - полиэлектролиты. Циклические метафосфорные кислоты (например, H3P3O9, H4P4O12) представляют собой сильные кислоты. Ультрафосфорные кислоты мало изучены.
Конденсированные Фосфорные кислоты получают дегидратацией ортофосфорных кислот, гидратацией фосфорного ангидрида соответствующим количеством воды, а также путем ионного обмена из соответствующих конденсированных фосфатов. Применяют в основном для производства высококонцентрированных фосфорных удобрений, в качестве катализаторов при получении нефтепродуктов и в органическом синтезе, для производства различных полифосфатов.
Галогениды фосфора, соединения фосфора с галогенами, из которых важны и хорошо изучены тригалогениды PX3. Известны, но менее изучены моногалогениды PX (например, PCl, PBr); дигалогениды P2X4 (например, P2C4, P2F4); смешанные галогениды фосфора типа PFCl2, PF3Cl2; полигалогениды, содержание галогена в которых более пяти (например, PBr7, PCl6I), и оксигалогениды (например, POCl3, POFз).
Галогениды фосфора чрезвычайно реакционноспособны, причём химическая активность уменьшается от фторидов к иодидам; в вакууме перегоняются без разложения, водой легко гидролизуются. Галогениды фосфора способны образовывать соединения типа PCl3× 5NH3 в безводных средах: PF3, PCl3, PBr3; пентагалогениды PX5: PF5, PCl5, PBr5.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Из галогенидов фосфора наиболее изучены трихлорид и пентахлоридфосфора.
Трихлорид фосфора (трёххлористый фосфор) PCl3, бесцветная жидкость, t пл. – 93, 6 °С, t кип76, 1 °C, плотность 1, 575 г/см3 при 20 °С; растворим в эфире, бензоле, хлороформе, сероуглероде, четырёххлористом углероде. Легко гидролизуется, образуя фосфористую и соляную кислоты. Получают хлорированием белого фосфора в растворе PCl3 (в лабораторных условиях белый фосфор заменяют красным). Используют для синтезафосфорорганических соединений. PCl3 токсичен, вызывает ожоги, раздражает глаза, дыхательные пути.
Пентахлорид фосфора (пятихлористый фосфор) PCl5, зеленовато-белые кристаллы, t пл 167 °С (в запаянной трубке), плотность 2, 11 г/см3, легко сублимируется, растворим в четырёххлористом углероде и сероуглероде, в воде гидролизуется с образованием оксихлорида POCl3 и соляной кислоты. Получают хлорированием PCl3. Используется в основном как хлорирующий реагент в органическом синтезе. PCl3 токсичен.
Оксихлорид фосфора — неорганическое соединение с формулой POCl3, бесцветная жидкость, дымит на воздухе. В холодной воде и спирте разлагается.
Хорошо растворяется в бензоле, хлороформе, сероуглероде, четыреххлористом углероде.
Дымит на воздухе вследствие разложения водяными парами с образованием фосфорной кислоты и хлороводорода:

Реагирует с щелочами:

Используется для получения других оксигалогенов фосфоров:

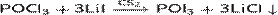
Получение:
· Действие хлористого водорода на оксид фосфора:

· Действие хлорида фосфора на оксид фосфора:

· Окисление кислородом трихлорида фосфора:

· Разложение пентахлорида фосфора:




|
|
