
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Завдання. 1. Обережно відкрити кран 4, визначити час витікання 300 мл води
|
|
1. Обережно відкрити кран 4, визначити час  витікання 300 мл води. Визначити за допомогою манометра різницю тисків
витікання 300 мл води. Визначити за допомогою манометра різницю тисків  . Дослід повторити 5-7 разів. Знайти середнє значення
. Дослід повторити 5-7 разів. Знайти середнє значення  і
і  .
.
2. Використовуючи формулу (7), визначити динамічну в’язкість 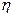 . Радіус капіляра і його довжина дані як постійні приладу.
. Радіус капіляра і його довжина дані як постійні приладу.
3. За формулою (3) визначити швидкість молекул газу.
4. За формулою (4) знайти густину газу. При цьому тиск повітря 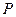 , його температура
, його температура  визначається за показами термометра і барометра, які є в приміщенні лабораторії.
визначається за показами термометра і барометра, які є в приміщенні лабораторії.
5. Використовуючи формули (5) і (6), визначити ефективний діаметр молекул повітря.
6. Знайти похибки визначення  і
і 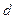 .
.
Контрольні запитання
1. В чому суть методу визначення середньої довжини вільного пробігу молекул в цій роботі?
2. Яка методика визначення динамічної в’язкості повітря в даній роботі?
3. Чому діаметр молекул називається ефективним?
Лабораторна робота № 2.03. Визначення показника адіабати повітря
Вступ
Питомою теплоємністю називається фізична величина, яка чисельно дорівнює кількості теплоти, яку необхідно надати 1 кг речовини для підвищення температури на 1 К. Ця величина вимірюється в Дж/(кг·К). Теплоємність газів залежить від способу їх нагрівання. Тому для газів розрізняють дві теплоємності: Теплоємність при постійному об’ємі  і
і 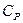 , що відповідає нагріванню газу при ізобарному процесі. Виходячи з першого закону термодинаміки і рівняння стану ідеального газу, можна показати, що для 1 моля ідеального газу
, що відповідає нагріванню газу при ізобарному процесі. Виходячи з першого закону термодинаміки і рівняння стану ідеального газу, можна показати, що для 1 моля ідеального газу
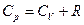 . (1)
. (1)
Співвідношення (1) називається рівнянням Майєра, зміст якого полягає в тому, що при ізобарному нагріванні газу на 1 К витрачається більша кількість теплоти, ніж при такому ж ізохорному нагріванні. Різниця кількостей теплоти дорівнює роботі, здійснюваній газом при ізобарному розширенні.
Співвідношення теплоємностей 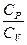 є характерною величиною для кожного газу. Згідно з кінетичною теорією газів, це співвідношення дорівнює
є характерною величиною для кожного газу. Згідно з кінетичною теорією газів, це співвідношення дорівнює
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
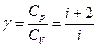 , (2)
, (2)
де 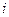 – число ступенів свободи молекул. Число
– число ступенів свободи молекул. Число 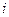 для одноатомних газів дорівнює 3, для двохатомних – 5, для багатоатомних – 6. Величина
для одноатомних газів дорівнює 3, для двохатомних – 5, для багатоатомних – 6. Величина 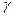 входить також в рівняння Пуассона (рівняння адіабати), яке зв’язує параметри газу – тиск і об’єм при адіабатному процесі:
входить також в рівняння Пуассона (рівняння адіабати), яке зв’язує параметри газу – тиск і об’єм при адіабатному процесі:
 . (3)
. (3)
Крива, яка описується цим рівнянням, називається адіабатною, а величина g – показник адіабати. Часто використовується інша форма рівняння Пуассона
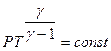 , (4)
, (4)
де  – термодинамічна температура. Адіабатичним називається процес, який протікає без теплообміну з зовнішнім середовищем (при умові
– термодинамічна температура. Адіабатичним називається процес, який протікає без теплообміну з зовнішнім середовищем (при умові  ).В даній роботі для визначення сталої адіабати використовується процес адіабатного розширення повітря.
).В даній роботі для визначення сталої адіабати використовується процес адіабатного розширення повітря.
Метод визначення 
 Рис. 2.5
Рис. 2.5
|
Установка (рис. 2.5) представляє собою посудину 1, заповнену повітрям і під’єднану до водяного манометра 2 і ручного насосу 3. За допомогою крану 4 посудина може з’єднуватись з атмосферою. Нехай спочатку повітря в посудині об’ємом  , знаходиться під тиском
, знаходиться під тиском 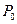 . Якщо за допомогою насосу нагнітати в посудину деяку кількість повітря, то тиск і температура повітря всередині посудини підвищаться. Через деякий час (при закритих кранах 4 і 5) внаслідок теплообміну з оточуючим середовищем температура повітря в посудині зрівняється з температурою зовнішнього середовища
. Якщо за допомогою насосу нагнітати в посудину деяку кількість повітря, то тиск і температура повітря всередині посудини підвищаться. Через деякий час (при закритих кранах 4 і 5) внаслідок теплообміну з оточуючим середовищем температура повітря в посудині зрівняється з температурою зовнішнього середовища  , а тиск, що встановиться в посудині, дорівнює
, а тиск, що встановиться в посудині, дорівнює  , де
, де 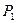 – додатковий тиск, вимірюваний різницею висот рівнів рідини в манометрі. Цей перший стан повітря в посудині характеризується параметрами
– додатковий тиск, вимірюваний різницею висот рівнів рідини в манометрі. Цей перший стан повітря в посудині характеризується параметрами  ,
,  ,
,  . Якщо тепер відкрити на короткий час кран 4, то повітря в посудині буде розширюватися адіабатно, оскільки за короткий проміжок часу не встигне здійснитися теплообмін між повітрям в посудині і зовнішнім середовищем. В кінці адіабатного розширення повітря в посудині встановлюється атмосферний тиск, температура знижується до
. Якщо тепер відкрити на короткий час кран 4, то повітря в посудині буде розширюватися адіабатно, оскільки за короткий проміжок часу не встигне здійснитися теплообмін між повітрям в посудині і зовнішнім середовищем. В кінці адіабатного розширення повітря в посудині встановлюється атмосферний тиск, температура знижується до 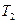 , а об’єм залишається рівним
, а об’єм залишається рівним  . Це буде другий стан повітря (параметри
. Це буде другий стан повітря (параметри 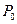 ,
,  ,
, 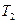 ). Якщо зразу в кінці адіабатного процесу, коли тиск в посудині впаде до атмосферного, закрити кран 4, то охолоджене повітря в посудині буде нагріватися і його тиск почне зростати. Тиск зросте до величини
). Якщо зразу в кінці адіабатного процесу, коли тиск в посудині впаде до атмосферного, закрити кран 4, то охолоджене повітря в посудині буде нагріватися і його тиск почне зростати. Тиск зросте до величини  , коли повітря в посудині нагріється до температури зовнішнього середовища
, коли повітря в посудині нагріється до температури зовнішнього середовища  . Таким чином, третій стан газу характеризується параметрами
. Таким чином, третій стан газу характеризується параметрами  ,
,  і
і  .
.
Адіабатний перехід з першого стану до другого описується рівнянням (4):
 (5)
(5)
Перехід від другого стану до третього проходить без зміни об’єму (ізохорний процес). Застосувавши до цього переходу рівняння, що описує ізохорний процес, одержимо:
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
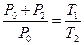 . (6)
. (6)
Розв’язуючи сумісно рівняння (5) і (6), знайдемо:
 (7)
(7)
Так як тиски 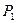 і
і  , вимірювані манометром, пропорційні відповідним різницям висот в манометрі
, вимірювані манометром, пропорційні відповідним різницям висот в манометрі  і
і  , то остаточно
, то остаточно
 . (8)
. (8)
|
|
