
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Завдання. 1. Залити в аспіратор воду, а посудину 1 заповнити дистильованою водою до такого рівня, щоб кінець трубки 5 знаходився від поверхні води на віддалі не більше
|
|
1. Залити в аспіратор воду, а посудину 1 заповнити дистильованою водою до такого рівня, щоб кінець трубки 5 знаходився від поверхні води на віддалі не більше 0, 5 мм.
2. Відкривши кран 6 встановити в системі атмосферний тиск. Рівні рідин в колінах манометра при цьому вирівнюються.
3. Закрити кран 6, відкрити кран аспіратора настільки, щоб зміна тиску відбувалась достатньо повільно і можна було відрахувати висоти рівнів в манометрі в момент відриву бульбашки.
4. Після встановлення певної частоти утворення бульбашок почати відлік по манометру, відмічаючи різницю рівнів в момент відриву кожної бульбашки. Провести не менше 10 відліків і знайти середнє значення різниці рівнів. Виміряти температуру термостата.
5. Розрахувати за формулою (1) коефіцієнт пропорційності – постійну приладу  .
.
6. Аналогічно визначити поверхневий натяг для досліджуваного розчину при різних температурах. Побудувати графік залежності 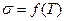 . Визначити
. Визначити  для різних концентрацій даного розчину при постійній температурі і побудувати графік залежності
для різних концентрацій даного розчину при постійній температурі і побудувати графік залежності  від концентрації.
від концентрації.
Контрольні запитання
1. Яка температура називається критичною?
2. Яка формула тиску викривленої поверхні рідини?
3. Яка методика визначення поверхневого натягу в даній роботі?
Лабораторна робота № 2.06. Визначення приросту ентропії при плавленні речовини
Вступ
Ентропія є функція стану макросистеми, що характеризує напрямок протікання самовільних процесів в ізольованій термодинамічній системі. Якщо система переходить  з одного стану в інший, то зміна ентропії в результаті такого процесу не залежить від виду процесу, а визначається різницею ентропії системи в кінцевому і початковому станах. Зміна ентропії в системі при нескінченно малій зміні її стану дорівнює:
з одного стану в інший, то зміна ентропії в результаті такого процесу не залежить від виду процесу, а визначається різницею ентропії системи в кінцевому і початковому станах. Зміна ентропії в системі при нескінченно малій зміні її стану дорівнює:
 , (1)
, (1)
де  – ентропія,
– ентропія,  – термодинамічна температура системи,
– термодинамічна температура системи, 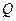 – кількість теплоти, що надається системі. При кінцевому оборотному переході системи з стану 1 в стан 2 зміна ентропії дорівнює:
– кількість теплоти, що надається системі. При кінцевому оборотному переході системи з стану 1 в стан 2 зміна ентропії дорівнює:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
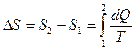 . (2)
. (2)
У випадку ізотермічного процесу  . Наприклад, зміна ентропії при випаровуванні рідини дорівнює скритій теплоті випаровування, поділеній на температуру випаровування. Для довільного кругового оборотного процесу
. Наприклад, зміна ентропії при випаровуванні рідини дорівнює скритій теплоті випаровування, поділеній на температуру випаровування. Для довільного кругового оборотного процесу  . Всі реальні процеси в ізольованих системах відбуваються таким чином, що ентропія системи зростає. В цьому твердженні міститься зміст другого закону термодинаміки.
. Всі реальні процеси в ізольованих системах відбуваються таким чином, що ентропія системи зростає. В цьому твердженні міститься зміст другого закону термодинаміки.
Метод вимірювання
В даній роботі визначають зміну ентропії  при нагріванні і охолодженні олова масою
при нагріванні і охолодженні олова масою  . Кількість теплоти, необхідна для нагрівання олова від початкової температури
. Кількість теплоти, необхідна для нагрівання олова від початкової температури  до температури плавлення
до температури плавлення 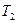 визначається, як відомо, по формулі
визначається, як відомо, по формулі
 , (2)
, (2)
де  – питома теплоємність олова. Кількість теплоти
– питома теплоємність олова. Кількість теплоти  , затрачена на плавлення олова при постійній температурі
, затрачена на плавлення олова при постійній температурі 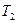 , дорівнює:
, дорівнює:
 , (3)
, (3)
де  – питома теплота плавлення олова. Зміна ентропії при нагріванні олова визначається за формулою:
– питома теплота плавлення олова. Зміна ентропії при нагріванні олова визначається за формулою:
 (4)
(4)
Після інтегрування одержимо:
 (5)
(5)
 Рис. 2.7
Рис. 2.7
|
Установка (рис. 2.7) складається з тигельної печі (1), термопари (2), мілівольтметра, включеного в коло термопари і тигля з оловом (3), розміщеного в печі. Один з кінців термопари розміщено в тигель з оловом (3), другий знаходиться в посудині з маслом (4) при кімнатній температурі. Температура плавлення олова визначається за показами мілівольтметра.
Завдання
1. Визначити зважуванням масу олова, розмістити тигель з оловом у піч і встановити термопару.
2. Включити піч, нагріти і розплавити олово. Визначити температуру плавлення олова та поміряти температуру масла.
3. По формулі (5) визначити приріст ентропії. Визначити похибки.
Контрольні запитання:
1. Який фізичний зміст ентропії?
2. В чому полягає зміст другого закону термодинаміки?
3. Які термодинамічні процеси називаються оборотними?
Лабораторна робота № 2.07. Визначення питомої теплоємності металів
Метод визначення теплоємності
 Рис. 2.8
Рис. 2.8
|
Прирівнюючи швидкості охолодження двох нагрітих зразків (швидкості зниження їх температур), можна визначити теплоємність одного з них, якщо відома теплоємність другого. Кількість теплоти  , яку віддає металевий зразок масою
, яку віддає металевий зразок масою  при зниженні його температури на
при зниженні його температури на  , визначається як відомо, за формулою:
, визначається як відомо, за формулою:
 , (1)
, (1)
де  – питома теплоємність металу. Ця ж кількість теплоти переноситься через площадку поверхні зразка в оточуюче середовище і ії можна визначити за законом теплопровідності Фур’є
– питома теплоємність металу. Ця ж кількість теплоти переноситься через площадку поверхні зразка в оточуюче середовище і ії можна визначити за законом теплопровідності Фур’є
 , (2)
, (2)
де  – коефіцієнт теплопровідності,
– коефіцієнт теплопровідності,  – градієнт температури, тобто зміна температури на одиницю довжини в напрямку нормалі до поверхні зразка. Таким чином
– градієнт температури, тобто зміна температури на одиницю довжини в напрямку нормалі до поверхні зразка. Таким чином
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
 (3)
(3)
Записавши це співвідношення для двох зразків з врахуванням того, що для однакових по розмірах і формі зразків  ,
,  однакові, то
однакові, то
 . (4)
. (4)
Установка (рис. 2.8) складається з електропечі 1 з боковим отвором, в який вставляють зразки 2, виготовлені у вигляді однакових циліндрів. В кожному із зразків є канал, у який вставляють термопару, підключену до гальванометра 3, шкала якого проградуйована в градусах Цельсія.
|
|
