
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
МОДУЛЬ №4 4 страница
|
|

2. ВНУТРІШНЬОКЛІТИННИЙ ОБМІН ЛІПІДІВ. ОБМІН ТРИГЛІЦЕРИДІВ.
Цей етап обміну ліпідів є найважливішою ланкою в ланцюг численних перетворень їх в органімі. Саме на цьому етапі проходять катаболічні й анаболічні реакції, які забезпечують як асиміляцію ліпідів у вигляді пластичного матеріалу, так і окиснення їх до кінцевих продуктів. Під час окиснення ліпідів вивільняється значна кількість енергії, яка нагромаджується в макроергічних зв’язків АТФ. Внутрішньоклітинний метаболізм різних груп ліпідів крім спільних ознак має специфічні особливості.
ОБМІН ТРИГЛІЦЕРИДІВ.
Розщеплення тригліцеридів. Одним з досить важливих етапів використання тригліцеридів у тканинах організму є розщеплення їх на складові частини – гліцерин і вищі жирні кислоти. Процес проходить за участю тканинних ліпаз. Перетворення гліцерину і жирних кислот протікає різними шляхами, що видно з наведеної схеми:
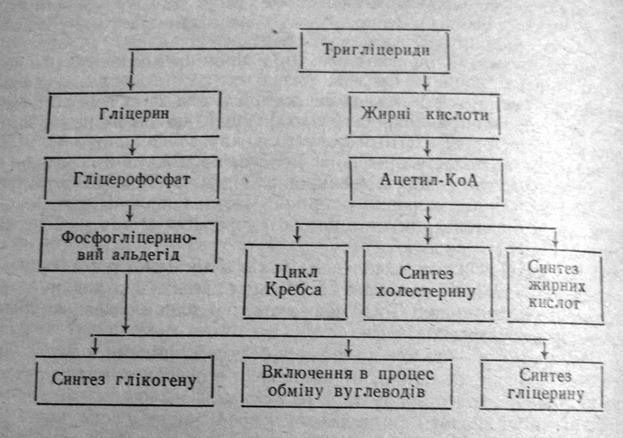
Окислення гліцерину. Як видно з наведеної схеми, гліцерин, незалежно від дальшого використання у тканинах організму, насамперед піддається реакції фосфорилювання за участю АТФ при каталітичній дії ферменту гліцераткінази:

3. БІОСИНТЕЗ ЛІПІДІВ.
Біосинтез гліцерину. В організмах людини і тварин основним шляхом утворення гліцерину є відношення діоксіацетонмонофосфату – проміжного продукту обміну вуглеводів за участю ферменту гліцерофосфатдегідрогенази:

Утворення гліцерину в організмі проходить також при гідролітичному розщепленні тригліцеридів і фосфогліцеринів під впливом тканинних ліпаз.
Біосинтез жирних кислот. Цей процес, на відміну від β - окиснення, проходить у розчинній частині цитоплазми за складним механізмом, який забезпечується рядом факторів і цитоплазматичних ферментних систем.
Мітохондрії й ендоплазматичний ретикулум не беруть безпосередньої участі в цьому синтезі. Проте в них здійснюються процеси нарощування (подовження) вуглецевих ланцюгів жирних кислот, які містять від 12 до 16 атомів вуглецю.
Дослідженнями було встановлено, що в процесі синтезу жирних кислот важливу роль відіграють ацетил- КоА, малоніл- КоА, НАДФ∙ Н+Н, іони гідрокарбонату натрію та двовалентних металів (Мg), а також складний полі ферментний комплекс синтетаза жирних кислот.

Лекція №22
Біохімія обміну води та мінеральних елементів
[2.с.488-508; 4.с.545-550]
План
1.Біохімічні та фізіологічні функції води в організмі людини
1.1.Молекулярна будова та біофізичні властивості води.
1.2.Біохімічні та фізіологічні функції води.
1.3.Вміст та розподіл води в організмі людини.
1.4.Водний баланс організму.
2.Біохімічні функції мінеральних елементів та електролітів
2.1.Макроелементи та електроліти.
2.2.Мікроелементи.
Біохімічні та фізіологічні функції води в організмі людини
Вода та розчинені в ній мінеральні солі складають внутрішнє середовище організму людини, створюючи фізико-хімічні та біохімічні умови для протікання біохімічних реакцій і здійснення відповідних фізіологічних функцій окремих клітин, тканин та органів. Визначальну роль у підтриманні водно-сольового гомеостазу відіграють нирки, які шляхом утворення сечі не тільки очищають кров від токсичних кінцевих продуктів метаболізму, а й забезпечують регуляцію необхідних для функціонування ферментних систем іонного та кислотно-основного балансу.
Незважаючи на те, що вода та мінеральні елементи не є енергетичними джерелами, живі організми не здатні виносити тривалого зневоднення. Якщо повне голодування людина може витримувати декілька тижнів, без надходження в організм води смерть наступає вже через кілька діб. Така життєва необхідність води пов’язана з виконанням нею ряду важливих біохімічних та фізіологічних функцій, які, у свою чергу, визначаються особливостями молекулярної будови води та її біофізичними властивостями.
1.1Молекулярна будова та біофізичні властивості води.
Дипольна будова молекули води
Внаслідок неспівпадіння центрів позитивних та негативних зарядів молекула води асиметрична (величина кута між зв’язками О-Н складає близько 105°) і являє собою постійний електричний диполь. Дипольні властивості молекул води є причиною її надзвичайно високої полярності та дипольного моменту. Завдяки цьому вода значно послаблює взаємне притягання протилежно заряджених іонів і є ефективним розчинником для органічних та неорганічних сполук, здатних до електролітичної дисоціації. Ця характеристика води обумовлює її надзвичайно важливу функцію як розчинника для біомолекул та середовища для протікання біохімічних реакцій.
Кластерна будова рідкої води
Молекули рідкої води схильні до утворення міжмолекулярних асоціатів (кластерів). Міжмолекулярна асоціація молекул рідкої води пояснюється взаємним притяганням різнойменних кінців диполів та стабілізується утворенням між окремими молекулами водневих зв’язків (рис. 31.1)

Відповідно до зазначеного, рідка вода являє собою фізико-хімічну систему, що утворена вільними молекулами (частково) та кластерами з 2-х, 3-х або 4-х молекул (переважно), які знаходяться між собою у стані динамічної рівноваги. Кластерна структура рідкої води визначає такі її фізико-хімічні властивості, необхідні для реалізації біологічних функцій води, як висока теплоємність, висока теплопровідність, та висока теплота пароутворення. Зазначені біофізичні якості пояснюють значення рідкої води в процесах терморегуляції цілісного організму людини.
Біохімічні та фізіологічні функції води.
Виходячи з розглянутих хімічних та фізико-хімічних властивостей води, можна визначити такі її життєво важливі біохімічні та фізіологічні функції:
значення води, як універсального розчинника біомолекул, мінеральних речовин та електролітів (Na+, К+, Са² +) в клітинах та позаклітинних просторах організму;
роль молекул води в утворенні водневих зв’язків з молекулами білків, нуклеїнових кислот, вуглеводів тощо, що має значення для формування їх просторової будови, міжмолекулярної взаємодії та зв’язування з різними лігандами;
безпосередня участь води у біохімічних ферментативних реакціях (реакції гідролізу білків, ліпідів, полісахаридів; метаболічні реакції гідратації та дегідратації);
значення воли у підтриманні осмотичного та онкотичного тиску в позаклітинних та внутрішньоклітинних рідинах організму людини (за рахунок утворення гідратних оболонок навколо заряджених молекул низькомолекулярних електролітів, білкових молекул тощо);
роль води в регуляції кислотно-основного стану в організмі, як компонента фізіологічно важливих буферних систем;
роль води в процесах терморегуляції (теплообміну, тепловіддачі, теплопровідності);
роль води в міжклітинному і міжорганному транспорті біомолекул в судинних системах організму – кров’яному, лімфатичному руслі (за рахунок високих реологічних якостей води).
1.3.Вміст та розподіл води в організмі людини.
Загальний вміст води в організмі дорослої людини становить в середньому 60 % у чоловіків та 55 % у жінок. Існують суттєві вікові відмінності у вмісті води, що становлять: у новонароджених дітей 75-80 %, у дорослої людини – 60 %, у осіб старечого віку – 40-45 %, тобто відбувається зменшення гідрофільності тканинних колоїдів з віком.
Розподіл води в організмі людини (водні простори організму): близько ⅔ (66 % всієї кількості води організму) є внутрішньоклітинною водою (міститься внутрішньоклітинно); ⅓ (33 %) – позаклітинною водою (утворює позаклітинні рідини організму); близько 8% загальної води організму є внутрішньосудинною водою (входить до складу плази крові).
1.4.Водний баланс організму.
Під водним балансом людини розуміють взаємовідношення між кількістю води, що надходить щодобово у складі рідких та твердих продуктів харчування, ендогенно утворюється в організмі (˝ оксидаційна вода˝) і кількістю води, що постійно виводиться різними шляхами екскреції (табл. 31.1).
Таблиця 31.1.
Показники добового водного балансу здорової людини
| Вода, що надходить та утворюється в організмі | Вода, що виділяється з організму |
| Вода продуктів харчування – 1100 мл Ендогенна (оксидаційна) вода – 400 мл | Нирками – 500 мл Шкірою – 500 мл Легенями – 400 мл Кишечником – 100 мл |
| Усього: 1500 мл | Усього: 1500 мл |
Таким чином, нормальний водний баланс у людини від’ємний - кількість води, що виводиться з організму щодобово, приблизно на 35 % перевищує кількість води. що надходить з твердими та рідкими продуктами харчування, що пояснюється утворенням додаткової кількості води за рахунок процесів біологічного окислення основних поживних речовин (жирів, вуглеводів та білків).
2.Біохімічні функції мінеральних елементів та електролітів
Мінеральні (неорганічні) елементи, що містяться а організмі людини, поділяються на: макроелементи – їх кількість становить декілька грамів (натрій, калій, кальцій, магній, хлор, фосфор, сірка) та мікроелементи, що визначаються в кількості декількох грамів (залізо*, мідь, цинк, марганець, селен, молібден, йод, кобальт, фтор, кремній). Макро- та мікроелементи виконують важливі структурні, каталітичні та регуляторні функції. Серед мінеральних мікроелементів найбільш поширеними є електроліти, до яких належать катіони Na⁺, K⁺, Ca² ⁺ та Mg² ⁺ і аніони хлору, бікарбонату, одно – та двозаміщених фосфатів.
2.1.Макроелементи та електроліти.
Натрій (Na⁺) – основний позаклітинний катіон, що відіграє головну роль у процесах підтримання об’єму води та осмотичного тиску в позаклітинних просторах організму. Нормальна позаклітинна концентрація іонів натрію становить 135 – 145 ммоль⁄ л, внутрішньоклітинна – 4-10ммоль⁄ л.
Біохімічними та біофізичними функціями іонів натрію є: участь у генерації мембранного потенціалу дії на плазматичних мембранах збудливих клітин, забезпечення протидії змінам внутрішньоклітинного осмотичного тиску, участь у функціонуванні бікарбонатних буферних систем тощо. Трансмембранний градієнт іонів натрію підтримується його активним викачуванням з клітин за рахунок функціонування натрієвого насоса, інтегральним компонентом якого є мембранозв΄ язний фермент – Na⁺, K⁺ - АТФаза.
Добова потреба організму людини у хлориді натрію становить 13 -15 г. Регуляція балансу натрію здійснюється за рахунок дії мінералокортикоїду альдостерону, функціонально пов’язаної з ним ренін-ангіотензинової системи та пептидів натрійуретичної системи тканин. Надлишкове надходження в організм людини натрію вважається фактором ризику для розвитку артеріальної гіпертензії. Збільшена затримка позаклітинного натрію призводить до виникнення тканинних набряків.
Калій (K⁺) – основний внутрішньоклітинний катіон, що забезпечує осмотичний тиск і об’єм внутрішньоклітинних рідин. Внутрішньоклітинна концентрація К⁺ у людини становить близько 160 ммоль⁄ л, позаклітинна – 4, 0 ммоль⁄ л. Добова потреба організму в калії – 2-3 г.
Біохімічні та біофізичними функціями іонів калію є: участь у підтриманні та генерації мембранного потенціалу в клітинах збудливих тканин, роль як кофактора у функціонуванні окремих біохімічних перетворень – біосинтезі білків, глікогену, газотранспортній функції гемоглобіну.
Порушення нормального балансу калію найчастіше спостерігається у вигляді збіднення організму цим електролітом. Збільшена втрата організмом калію (через кишечник, нирки) може призводити до виникнення гіпокаліємії та зсувів у функціонуванні збудливих мембран нейронів та м’язів, клінічними проявами яких є м’язова слабкість, порушення серцевої діяльності.
Кальцій(Са² ⁺) – інтегральний компонент більшості біоструктур та еволюційно прадавній внутрішньоклітинний месенджер та біорегулятор. Реалізація різноманітної месенджерної дії кальцію відбувається через універсальний калієвий сенсор – білок кальмодулін. Розподіл кальцію в організмі, біохімічні механізми регуляції його гомеостазу за участі паратгормону, вітаміну D₃ і кальцитоніну та ферментні системи, залежні від іонів Са² ⁺, були детально розглянуті у розділах, присвячених біохімічним механізмам регуляції метаболізму.
Магній(Mg² ⁺) – переважно внутрішньоклітинний катіон; роль іонів магнію полягає в їх участі як активаторів та кофакторів багатьох ферментів: реплікації нуклеїнових кислот, біосинтезу білка, Mg² ⁺ - залежних АТФаз, ацетилхолін естерази. Катіон є також складовою частиною мінеральних солей, що входять до складу кісткового скелета та тканин зуба, необхідний для стабілізації структури рибосом.
Розподіл катіонів-електролітів в організмі людини представлений у табл. 31.2.
Таблиця 31.2.
Електролітичний склад рідин організму людини(моль⁄ л)
(за Л.М. Тарасенко та ін., 2000, зі змінами)
| Катіони | Плазма крові | Внутрішньоклітинна рідина |
| Na⁺ | ||
| K⁺ | ||
| Ca² ⁺ | 2, 5 | |
| Mg² ⁺ | 1, 5 |
2.2.Мікроелементи.
Залізо (Fe² ⁺ - Fe³ ⁺) – мікроелемент, що є структурним елементом білків гемоглобіну, міоглобіну та входить до складу активних центрів ряду електронотранспортних ферментів – залізопорфіринів цитохромів дихального ланцюга мітохондрій, мікросомальної оксигенази цитохрому Р-450, пероксидаз, каталази т. і.
Іони заліза надходять в організм людини у складі продуктів харчування, і після їх всмоктування у травному каналі відбувається біотранспорт заліза в судинному руслі за участю спеціального транспортного білка трансферину. Більша частина іонів заліза депонується у складі феритину печінки та селезінки, звідки залізо звільняється для участі в біосинтезі відповідних Fe² ⁺ - залежних ферментних білків.
Порушення всмоктування заліза в кишечнику та підвищення його витрат організмом (за умов вагітності, лактації, крововтрат) є причиною гіпосидерозу та розвитку залізодефіцитної анемії. З метою відновлення кількості гемоглобіну в умовах збільшення витрат заліза застосовують фармацевтичні препарати цього елемента.
Мідь(Cu⁺ - Cu² ⁺) – мікроелемент, що виконує каталітичні функції як кофактор у складі багатьох окислювально - відновновлювальних ферментів: цитохрому а₃ (цитохромоксидази), супероксиддисмутази, тирозинази.
Міжорганний транспорт міді в плазі крові здійснюється за участю білка церулоплазміну.
Клініко-біохімічними проявами дефіциту міді (гіпокупорозу) є: анемія, порушення синтезу колагену, деформація скелета. Наслідком надмірного накопичення міді в нейронах головного мозку та клітинах печінки внаслідок спадкових порушень його метаболізму є виникнення хвороби Вільсона – Коновалова (гепатоцеребральна дистрофія)
Лекція №23
Взаємозв’язок між обміном білків, вуглеводів і ліпідів
[ 2.с.509 - 515]
План
1. Взаємозв’язок між обміном вуглеводів і ліпідів
2. Взаємозв’язок між обміном вуглеводів і білків
3. Взаємозв’язок між обміном білків і ліпідів
Обмін речовин в організмі як один з основних проявів життєдіяльності - єдиний біологічний процес. Всі перетворення речовин і енергії, процеси синтезу і розкладання, анаболізму і катаболізму взаємозв’язані, взаємозумовлені і тонко координовані нейрогуморальними механізмами, що забезпечує існування організму як єдиної впорядкованої високоорганізованої системи.
1.Синтез жирів із вуглеводів. Взаємозв’язок між цими класами органічних сполук можна розглядати в двох аспектах – перетворення вуглеводів на ліпіди і перетворення ліпідів на вуглеводи.
Протікання процесу перетворення вуглеводів на ліпіди було доведено численними спостереженнями й експериментальними дослідженнями. З біохімічної точки зору процес перетворення вуглеводів на жири можна досить легко обґрунтувати. Відомо, що молекула жиру побудована з гліцерину і вищих карбонових кислот. Отже, основні процеси перетворення вуглеводів у ліпіди зводяться до утворення цих основних компонентів жиру. Зрозуміти ферментативні процеси, які зумовлюють перетворення вуглеводів на жири, допомагають дані щодо вивчення продуктів розщеплення вуглеводів. Проміжні продукти анаеробного розщеплення вуглеводів – діоксіацетонмонофосфат і фосфогліцеринальдегід – досить легко здатні відновлюватись до фосфогліцерину. Гідроліз фосфогліцерину за участю фосфатази призводить до утворення гліцерину. Крім того, діоксіацетонмонофосфат, який є спільним проміжним продуктом обміну вуглеводів і ліпідів, під час відновлення до гліцеринфосфату (активної форми гліцерину) може безпосередньо використовуватись для синтезу складних ліпідів (фосфогліцеридів).
Біосинтез вищих жирних кислот, необхідних для синтезу ліпідів, здійснюється за участю центрального метаболіту вуглеводного обміну – піровиноградної кислоти, в результаті окислювального декарбоксилювання її і утворення активного ацетату – ацетил-КоА. Ацетил-КоА вступає у реакцію конденсації, внаслідок чого утворюється ацетооцтова кислота, з якої далі синтезуються одноосновні високомолекулярні кетокислоти, які беруть участь в утворенні жирних кислот.
Отже, синтез жирних кислот із вуглеводів здійснюється через ацетил-КоА.
Синтез вуглеводів із ліпідів.
Найчастіше процес перетворення ліпідів у вуглеводи має місце в організмах тварин, які впадають у зимову спячку. Відомо, що ці тварини до початку зими нагромаджують значну кулькість жиру(до 50% від маси організму), а навесні кількість жиру у них зменшується до мінімуму. Енергетичні витрати тварину період сплячки зведені до мінімальних величин і задовольняються за рахунок розщеплення жирів, з яких у цей період утворюються вуглеводи. Доказом цього є досить низький дихальний коефіцієнт у цих тварин, а також те, що вміст глікогену в тканинах організмів тварин у період сплячки майже не змінюється. Крім того, досить обмежено витрачаються також білкові резерви.
Важливим підтвердженням можливості синтезу вуглеводів із ліпідів послужили дані з вивчення проміжних продуктів обміну вуглеводів та ліпідів в організмах людини і тварин, а також ферментних систем, які каталізують ці реакції. Виявилось, що спільним проміжним продуктом обміну вуглеводів і ліпідів є ацетил-КоА, який утворюється під час β -окислення жирних кислот і окислювального декарбоксилювання піровиноградної кислоти. Саме ацетил-КоА і є сполучною ланкою між обміном вуглеводів і ліпідів і становить молекулярну основу перетворення вуглеводів на ліпіди і ліпідів на вуглеводи.
Однак це не означає, що весь ацетил-КоА, що утворюється під час β -окисленняя жирних кислот, використовується для синтезу вуглеводів, а утворена при розщепленні вуглеводів ацетооцтова кислота перетворюється на жири.
Використання ацетил-КоА в організмі залежить від певних конкретних умов. Основна маса його за нормальних фізіологічних умов окислюється до СО2 і Н2О з виділенням енергії. Значна кількість його також використовується для синтезу різних сполук: холестерину, стероїдних гормонів, жирів, глікогену.
2. Синтез вуглеводів із білків (глюконеогенез). Можливість синтезу вуглеводів із білків було доведено в дослідах на тваринах з експериментальним цукровим діабетом та за умов їх голодування. При введенні в організми тварин з експериментальним цукровим діабетом білків і деяких амінокислот спостерігалось значне збільшення вмісту цукру в сечі – глюкозурія. Введення білків тваринам, що тривалий час голодували, сприяло відновленню запасів глікогену в печінці. Причому експериментально було встановлено, що, залежно від амінокислотного складу, із 100 г білків може утворюватися від 50 до 80 г глюкози. Найінтенсивніше вуглеводи синтезуються з тих амінокислот, які в процесі метаболізму перетворюються нв піровиноградну кислоту. Такі амінокислоти дістали назву глюкогенних. Це аспарагінова і глутамінова кислоти, серин, валін, орнітин, цистеїн, гліцин, аланін, метіонін, гістидин та ін. Глюкогенні амінокислоти після переамінування і дезамінування перетворюються на кетокислоти - щавлевооцтову, α -кетоглутарову, піровиноградну. Серед них саме піровиноградна кислота є основним метаболітом, який забезпечує перетворення амінокислот на вуглеводи. Щавлевооцтова й α -кетоглутарова кислоти після декарбоксилювання також перетворюються на піровиноградну кислоту.
Перетворення піровиноградної кислоти у вуглеводи може здійснюватися через ацетил-КоА, який утворюється під час її окислювального декарбоксилювання або внаслідок протилежно напрямлених реакцій гліколізу.
Важливе значення глюконеогенез має в екстремальних умовах, за яких необхідна адаптація організму до зміни умов зовнішнього середовища, коли енерговитрати організму збільшуються і значно підвищуються витрати глікогену.
Синтез білків із вуглеводів. З вуглеводів можна синтезувати амінокислоти, які входять до складу білків. Відомо, що вуглеводи є основним джерелом, з якого в організмі утворюються піровиноградна, щавлевооцтова та α -кетоглутарова кислоти. Дані кетокислоти внаслідок амінування перетворюються на відповідні амінокислоти: аланін, аспарагінову і глутамінову амінокислоти. Це так званий первинний синтез амінокислот в організмі. Крім того, глутамінова кислота здатна передавати свою аміногрупу кетокислотам і шляхом переамінування сприяти утворенню інших амінокислот. З глутамінової кислоти внаслідок зміни її вуглецевого ланцюга можуть синтезуватись пролін, гідроксипролін, орнітин. Ряд замінних амінокислот утворюється в організмі шляхом прямого амінування кетокислот (продуктів претворення вуглеводів) і аміаку.
Отже, з метаболітів вуглеводного обміну в організмі можуть синтезуватись більшість амінокислот, крім незамінних. Цим пояснюється незамінність білків у харчуванні.
3. Утворення ліпідів із білків. Піровиноградна кислота внаслідок декарбоксилювання перетворюється на ацетил-КоА, який може використовуватись для синтезу вищих жирних кислот.
Піровиноградна й оцтова кислоти можуть утворюватись з аспарагінової і глутамінової амінокислот після їх дезамінування і декарбоксилювання. Під час розкладання фенілаланіну, тирозину та інших амінокислот утворюється ацетооцтова кислота, яка теж може бути використана для синтезу жирів. Амінокислоти, які в процесі перетворення утворюють метаболіти, можуть використовуватись для синтезу жирів і називаються кетогенними.
З продуктів білкового обміну може синтезуватись також гліцерин. Так, аланін легко перетворюється в піровиноградну кислоту, яка під час зворотного гліколізу перетворюється в діоксіацетонмонофосфат – спільний метаболіт вуглеводного і жирового обміну, а далі легко перетворюється на гліцерин. Частина амінокислот, наприклад серин та його похідні, використовується для синтезу азотовмісної частини складних ліпідів (фосфатидів).
Утворення білків із ліпідів. Цей процес в організмах людини і тварин має обмежене значення. Центральне місце в перетворенні ліпідів у білки займає α -кетоглутарова кислота, оскільки вона легко піддається прямому амінуванню за участю аміаку і перетворенню в глутамінову. Оскільки з жирів утворюється незначна кількість кетокислот (піровиноградної і α -кетоглутарової), жири не можуть бути важливим джерелом синтезу білків.
Отже, процеси обміну білків, ліпідів і вуглеводів в організмі взаємозв’язані. Спільним метаболітом, який використовується в процесах взаємоперетворення, є ацетил-КоА, а останній – в жирні кислоти, які під час взаємодії з гліцерином утворюють жири. Внаслідок карбоксилювання піровиноградної кислоти утворюється щавлевооцтова кислота, а далі вона може утворювати дикарбонові амінокислоти – аспарагінову і глутамінову. Ці амінокислоти в реакціях переамінування сприяють біосинтезу всіх інших замінних амінокислот. Крім того, піровиноградна кислота здатна відновлюватись до молочної кислоти, яка використовується в процесах синтезу вуглеводів у тканинах організму.
Лекція №24
Перетворення жирів у технологічному процесі
План
1. Гідроліз жирів
2. Окиснення ацилгліцеринів. Роль антиоксидантів.
3. Переетерифікація жирів. Гідрогенізація та гідратація жирів.
1. Гідроліз жирів
Жири нестійкі при зберігання і переробці. Вони є найбільш лабільними компонентами харчової сировини і готових продуктів. Нестійкість жирів зумовлена особливостями їхньої хімічної будови. Перетворення ацилгліцеридів можна розділити на реакції, які протікають з участю складних ефірних груп, та реакції, які протікають з участю вуглеводневих радикалів.
Псування жирів відбувається як під дією ферментів мікроорганізмів, які розвиваються у плазмі (водному середовищі жиру), так і під дією кисню повітря. Дію цих факторів прискорює волога, підвищена температура, світло, солі металів (Cu, Fe, Zn, Pb).
Розрізняють гідролітичне і окислювальне псування жиру. Воно залежить від складу продукту і умов його зберігання.
Гідроліз – це розщеплення жирів на гліцерин і жирні кислоти.
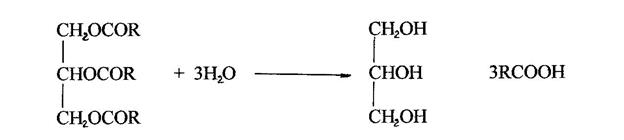
Насправді гідроліз йде в 3 стадії: спочатку утворюється дигліцерид, потім моно гліцерид і лише після цього утворюються кінцеві продукти.
Гідроліз спричиняється в основному ферментом ліпазою. Але може відбуватися і без неї при високій вологості і температурі зберігання при дії на жир  і світла.
і світла.
Поява в жирах високомолекулярних жирних кислот не змінює органолептичні показники продуктую Лише звільнення таких летких низькомолеклярних жирних кислот як масляна, капронова, каприлова, які мають неприємний запах, специфічний смак смак, негативно впливає на властивості олії, особливо масла, тригліцериди якого містять найбільше таких кислот.
Топлене масло і жир у герметичній упаковці при -5°С зберігається рік без змін, при -10-12°С – до 2-х років. При -16°С повністю зупиняється життєдіяльність мікроорганізмів.
2. Окиснення ацилгліцеринів. Роль антиоксидантів.
Ступінь окиснення олій і жирів залежить від ацилгліцеринового складу: зі збільшенням ступеня ненасиченості жирних кислот швидкість їх окиснення збільшується. Серед ефірів олеїнової, лінолевої, ліноленової кислот співвідношення швидкості окиснення відповідно становить 1: 27: 77. Ацилгліцерини насичених кислот киснем повітря за звичайних умов майже не окиснюються. Крім того, на швидкість цього процесу впливає присутність вологи, металів змінної валентності.
Окиснювальне псування за низьких температу у присутності кисню і світла. При цьому утворюються пероксиди, альдегіди, кетони, оксикислоти та інші сполуки з неприємним запахом і смаком. У результаті жир набуває прогірклого, сального смаку. Окисненню піддаються в першу чергу поліненасичені жирні кислоти, тобто найбільш біологчно цінна складова частина тригліцеридів жиру.
Жир окиснюється через ланцюгові реакції з утворенням проміжних продуктів пероксидного типу. Теорія ланцюгових вільнорадикальних реакцій розроблена академіком Н.Н.Семеновим. Суттєву роль на початковій стадії окиснення відіграють вільні радикали, які з’являються в жирі під впливом енергії світла, або теплової. Молекула, поглинаючи енергію переходить в активний стан  , стає нестійкою і легко розпадається на радикали:
, стає нестійкою і легко розпадається на радикали:

Які теж дуже активні і вступають в реакцію з киснем, утворюючи пероксидні радикали:

|
|