
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
МОДУЛЬ № 2
|
|
«Ферменти та коферменти (вітаміни)»
Лекція 6, 7
Ферменти
[ 1.с. 116-147; 2. с. 169-207; 4. с. 115-120 ]
План
1. Загальні поняття про ферменти.
2. Будова та властивості ферментів.
3. Загальні уявлення про механізм дії ферментів.
4. Номенклатура й класифікація ферментів.
5. Використання ферментів в харчовій промисловості.
1. Загальні поняття про ферменти.
В основі всіх процесів життєдіяльності організму лежать тисячі хімічних реакцій, що каталізуються особливими білками - ферментами (ензимами). Назва «фермент» походить від лат. fermentum (закваска); другий термін «ензим» - від грец. еп - усередині, гуте - дріжджі. Саме з процесів бродіння починається наука про ферменти.
Завдяки ферментам у живих організмах відбуваються такі дивні перетворення, які в інших умовах неможливі навіть при використанні найсучасніших досягнень науки і техніки. Так, наприклад, для розщеплення молекул пероксиду водню на молекулярний кисень і воду за наявності заліза необхідно було б 300 років, тоді як фермент каталаза здійснює цей процес у живій клітині за одну секунду.
За своєю дією біологічні каталізатори (ферменти) відрізняються від каталізаторів неживої природи. Як і білки, вони мають складну структуру, тоді як багато неорганічних каталізаторів - це низькомолекулярні речовини.
Ферменти характеризуються дуже високою активністю. Ферментативна реакція відбувається в 106-1012 разів швидше, ніж спонтанна реакція у водному розчині, яка не каталізується.
Усі ферменти виявляють свою активність за порівняно м’яких умов; за помірної температури (25-40 С), нормального тиску, невисокої концентрації водневих іонів, тобто за умов, коли хімічні речовини, що входять до складу організму, перетворюються без каталізатора дуже повільно. За низьких позитивних температур (0 °С) ферменти не руйнуються, але майже повністю втрачають активність.
Завдяки ферментним системам клітина здатна сама себе підтримувати в постійній динамічній рівновазі і налаштовуватися на роботу в режимі максимальної економії компонентів. Процеси, які відбуваються в живих організмах, набагато перевершують можливості сучасних хімічних технологій.
2. Будова та властивості ферментів.
За хімічною будовою ферменти становлять собою прості (ферменти-протеїни) і складні білки (ферменти-протеїди).
Ферменти-протеїни складаються лише із залишків амінокислот, тому їх називають однокомпонентними. Складні ферменти, крім білкової, містять і небілкову складову, тому вони одержали назву двокомпонентних.
Білкову частину складного ферменту називають апоферментом (носієм), небілкову - додатковою, простетичною групою, коензимом або коферментом (активна частина). Загальна назва складного ферменту - холофермент (від греч. holos ~ ціле).
Апофермент - термолабільний, як усі білки, кофермент - термостабільний
Тривіальна номенклатура. Тривіальні назви ферментів утворюються на основі хімічної назви субстрату з додаванням суфікса - аз(а). У біохімії існують також загальноприйняті, історично усталені назви ферментів, що не відображають хімічної природи реакції, зокрема пепсин, трипсин, тромбін, плазмін тощо. Тривіальну назву (або назви) ферменту звичайно подають у дужках.
Згідно із систематичною номенклатурою назва (найменування) ферменту містить у собі: хімічну назву субстрату або субстратів; тип реакції, що каталізується; а також суфікс - аз(а).
Усі ферменти є високомолекулярними біополімерами. Білкова природа ферментів визначає низку особливостей, що відрізняють їх від неорганічних каталізаторів.
Найважливіша особливість дії ферментів полягає в специфічності, що обумовлює вибірковість їхньої дії. Досить змінити просторове розташування атомів субстрату, щоб фермент не впливав на нього. Фермент може каталізувати одну або групу реакцій, близьких за своєю природою.
Залежно від того, чи може фермент каталізувати яку-небудь одну реакцію (тобто впливати на даний субстрат) або кілька реакцій (тобто впливати на визначену групу субстратів), розрізняють специфічність абсолютну і відносну.
Абсолютна специфічність характерна для ферментів, що діють на один субстрат з цілком визначеною структурою. Будь-які зміни в структурі субстрату унеможливлюють до нього доступ ферменту.
Відносні специфічність мають ферменти, що діють на певний вид зв’язку. Наприклад, пептидаз и гідролізують усі сполуки, що мають у своєму складі пептидний зв’язок - CO - NH.
З інших властивостей ферментів слід вказати на Оборотність їх дії. Залежно від концентрації вхідних і кінцевих продуктів реакції ферменти можуть каталізувати як прямі, так і зворотні реакції, тобто викликати як процеси синтезу, так і процесії розпаду. Уперше на цю особливість звернув увагу видатний російський хімік А.Я. Данилевський (1886). Він показав, що фермент шлункового соку пепсин, який розщеплює білки на пептони й альбумози (уламки білкової молекули), у певних умовах може каталізувати синтез білків з цих проміжних продуктів обміну білків. Однак пізніше було доведено, що зворотність дії характерна не для всіх ферментів.
Багато процесів розпаду і синтезу відбуваються не тільки під дією різних ферментів, але й за іншим механізмом. У живому організмі розщеплення і синтез здійснюються в більшості випадків різними ферментами навіть тоді, - коли даний фермент здатний каталізувати реакцію в різних напрямках. У синтезі беруть участь ферменти, що використовують енергію гідролізату АТФ і деяких інших сполук. Так, при гідролізі глікогену в печінці за допомогою амілази і мальтази утворюється глюкоза. З глюкози у печінці синтезується глікоген, але його утворення не є результатом зворотної реакції гідролізу, а відбувається більш складним шляхом.
Для ферментів характерна чутливість до зміни температури особливо до її підвищення. Висока температура, яка денатурує білки, інактивує ферменти.
У разі зниження температури (гіпотермія) активність ферментів знижується, але не зникає. Установлено, що в холодильних камерах у замороженому м’ясі відбувається повільне розщеплення білків під дією протеолітичних ферментів. Якщо для ферментів створюється температурний оптимум, вони знову стають активними. Прикладом може слугувати зимовий сон тварин. Цю здатність ферментів використовують у хірургії, кріобіології.
На активність ферментів впливає певна концентрація водневих іонів - pH середовища. Для кожного ферменту існує певна вузька межа pH середовища, що є оптимальним для реалізації його максимальної активності. Відхилення pH від оптимального значення призводить до зниження активності ферменту або навіть до його необоротної інактивації. Оптимальне значення pH середовища становить: для пепсину 1, 5-2, 5, трипсину 8, 0-8, 5, амілази слини 6, 8-7, 0, аргікази - 9, 7, гастриксину 9, 5-10, 0.
Швидкість ферментативних реакцій залежить не тільки від температури і pH середовища, але й від концентрації ферменту та субстрату, наявності активаторів і паралізаторів.
Швидкість дії ферменту визначається концентрацією фермент-субстратного комплексу, що утвориться.
Крім зазначених факторів, на активність ферментів впливає наявність у розчині певних хімічних сполук, що можуть активувати (активатори) або гальмувати (інгібітори) дію ферментів. Активатори представлені іонами багатьох металів (частіше за все Mg2+, Мn2+, K+, Co2+), деякими аніонами (СІ). Так, амілаза слини і підшлункової залози активується аніонами хлору; дію ліпази соку підшлункової залози стимулюють жовчні кислоти.
Інгібітори гальмують дію ферментів. Розрізняють два види інгібування - незворотне й зворотне. Незворотне інгібування по в’язане з дією таких речовин, що порушують усю структуру ферменту, у тому числі активного центру (наприклад, дія сильних кислот і лугів, солей важких металів).
Зворотне інгібування відбувається в період безпосередньої взаємодії ферменту з інгібітором, видалення якого знову повертає ферменту активність. Таке інгібування може відбуватися за конкурентним і неконкурентним типом.
Конкурентне гальмування можливе в тому випадку, коли інгібітор містить хімічні групи, подібні до субстрату, тобто є його структурним аналогом і здатний взаємодіяти з активним центром ферменту. В основі цього виду гальмування лежить конкуренція між субстратом і інгібітором за приєднання до активної групи ензиму
Інгібітори ферментів є в тканинах організму. У підшлунковій залозі виявлена речовина білкової природи, що гальмує активність трипсину. Відома також сполука, яка гальмує активність пепсину. Ці речовини називають антиферментами, їх дія має зворотний характер. У певних умовах антиферменти відщеплюються від ферментів, що сприяє відновленню активності останніх.
3. Загальні уявлення про механізм дії ферментів.
В основі дії ферментів як біологічних каталізаторів лежить їхня здатність прискорювати реакції шляхом зменшення енергії активації субстрату.
Механізм дії ферментів вивчений поки що недостатньо. Існуючі на сьогодні дані дозволяють навести тільки деякі загальні положення щодо цього питання.
Запуск реакції можна здійснити шляхом подолання сил відштовхування між молекулами, що зумовлене зовнішніми електронами. Ферменти деформують електронні оболонки субстратів, полегшуючи в такий спосіб взаємодію між ними. Енергія, необхідна для того, щоб привести молекули в активний стан, називається енергією активації. Вона використовується для подолання енергетичного бар’єра. Цей процес може здійснити каталізатор. Наприклад, енергія активації, необхідна для розкладання пероксиду водню 2Н2O2 → 2Н2O+O2, без каталізатора, становить 75, 2 кДж/моль, із застосуванням каталізатора - колоїдної платини - 50, 2 кДж/моль, за участю ферменту каталази печінки - 8, 3 кДж/моль. Таким чином, роль звичайного каталізатора (і в ще більшою мірою біологічного) полягає в тому, що він знижує енергію активації субстрату.
Існують дві теорії механізму дії ферментів - теорія проміжних сполук і адсорбційна.
Теорія проміжних сполук. Суть процесу полягає в утворенні фермент-субстратного комплексу (рис. 4.3). При безпосередній взаємодії субстрату з активним центром ферменту останній певним чином впливає на субстрат, викликаючи перебудову його хімічних зв’язків і тим самим активізуючи його.
Як приклад можна навести механізм дії фумарази (F), яка каталізує реакцію утворення яблучної кислоти з фумарової кислоти:
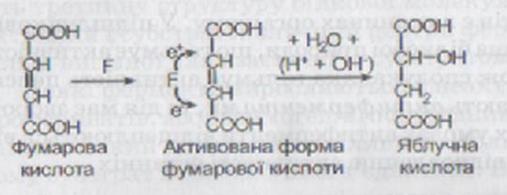
Подвійний зв’язок, що є у фумаровій кислоті, представлений електронними парами. Під час взаємодії фумарової кислоти з фумаразою відбувається утворення фермент-субстратного комплексу, у результаті чого функціональні групи активного центру ферменту сприяють перерозподілу електронів подвійного зв’язку. Унаслідок цього один із вуглецевих атомів отримує електрон і заряджається негативно, а інший, віддаючи електрон, - позитивно. Таким чином, молекула фумарової кислоти стає активованою і легко може приєднувати іони Н т і ОН’ (іони води) за типом електростатичного зв’язку та перетворюватися на яблучну кислоту.
Якщо позначити фермент буквою F, субстрат - S, активований субстрат - S] і продукт реакції - Р, то зазначену послідовність процесу можна подати у вигляді, схеми:
І II III IV
F + S - FS – FS1- FP - F + Р
Фермент зв’язується із субстратом в оборотній реакції з утворенням фермент-субстратного комплексу. У процесі утворення останнього і на подальших стадіях ферментативного каталізу відбуваються кількаразові зміни третинної структури ферменту, що зумовлюють послідовне зближення із субстратом і орієнтацію в просторі тих активних груп, які взаємодіють одна з одною на різних етапах перетворення субстратів. Зміна третинної структури білка можлива тільки за участі всього (або майже всього) поліпе- нтидного ланцюга, який утворює-молекулу білка. Отже, у каталітичному процесі бере участь уся молекула ферменту при впорядкованій взаємодії його центрів, що забезпечує послідовне здійснення багатостадійних процесів ферментативного каталізу. Спрямованість реакцій залежить від зміни енергії під час реакції, від різниці вільних енергій вихідних речовин і речовин, що утворюються.
Існує ще одна особливість дії ферментів: в організмі перетворення речовин до кінцевих продуктів відбувається в кілька етапів, кожний з яких каталізується окремим ферментом. Наприклад, синтез жирних кислот забезпечується групою ферментів, до складу якої входить сім ферментів.
Сума енергії активації проміжних реакцій нижча за енергію активації, необхідну для одночасного розщеплення субстрату.
Адсорбційна теорія. Відповідно до цієї теорії, речовини, які реагують, адсорбуються на поверхні ферменту, що сприяє збільшенню їх концентрації, зближенню реакційноздатних груп. Речовини, що знаходяться на поверхні ферменту (адсорбенту), можуть утримуватися внаслідок простої фізичної адсорбції, обумовленої силами міжмолекулярної взаємодії і більш міцного хімічного зв’язку. Каталізатор своїм силовим полем викликає певні зміни в структурі реагуючих речовин, що сприяє підвищенню реакційної здатності субстрату і збільшенню швидкості реакції.
Кожен фермент містить певні хімічні групи, завдяки яким він сполучається із субстратом і здійснює свою каталітичну дію.
Такими групами є SH-групи, залишки гістидину, серину, тирозину і т.п. Ці групи розташовані в молекулі ферменту на різних ділянках, але взаємодіють між собою і є відповідальними за каталітичну діяльність ферменту. Вони дістали назву функціональних груп ферментів.
У молекулі ферменту можлива комбінація різних хімічних груп, що утворюють активний центр у молекулі ферменту, завдяки якому здійснюється його каталітична дія.
Якщо в субстраті є заряджені групи, утворення FS-комплексу відбувається завдяки електростатичній взаємодії іонних зв’язків між позитивно зарядженими групами ферменту, і навпаки. Якщо субстрат не має заряджених груп, то приєднання ферменту до субстрату відбувається внаслідок утворення водневих зв’язків або гідрофобної взаємодії.
Кофактори, виконуючи каталітичну функцію, залишаються хімічно незмінними в результаті каталітичної реакції.
4. Номенклатура й класифікація ферментів.
Чинні номенклатура і класифікація ферментів були затверджені в 1961 році на V Міжнародному біохімічному конгресі в Москві. В основу номенклатури були покладені такі принципи:
а) суфікс -аз(а) слід використовувати тільки для простих ферментів; для мультиферментш-іх комплексів рекомендований термін «система» (наприклад, пірунатдегідрогенална система);
б) у найменуванні має бути відображений механізм реакції, назва субстрат і коферменту, тип реакції, яка каталізується.
З урахуванням цих правил замість колишньої назви, наприклад, «лактатдегідрогеназа» рекомендують систематичну назву лактат-НАД-оксидоредуктаза, що містить три позиції: субстратом є лактат (молочна кислота), коферментом - НАД (нікотинамідаденіндннуклеотид), фермент оксидоредуктаза каталізує транспорт водню від субстрату до акцептора, тобто зазначений тип реакції.
Усі ферменти поділяються на шість класів: оксидоредукта- зи, трансферази, гідролази, ліази, ізомерази, лігази(синтетази). Кожен клас має підкласи.
Оксидоредуктази. До цього класу віднесені всі ферменти (дегідрогенази, оксидази та ін.), які каталізують окисно-відновні реакції. Ці реакції здійснюються ланцюгом ферментів і проміжних переносників водню або електронів від первинного субстрату до кінцевого акцептора - кисшо. Особливістю оксидоредуктаз є їхня здатність прискорювати велику кількість найрізноманітніших окисно-відновних реакцій, що забезпечує сполучення коферменту з багатьма апоферментами. При цьому щораз утворюється оксидоредуктаза, специфічна для того чи іншого субстрату. Оксидоредуктази беруть участь у хімічних реакціях, пов’язаних з вивільненням енергії.
Трансферази. Ферменти цього класу здійснюють внутрішньо- і міжмолекулярне перенесення окремих функціональних груп. Залежно від характеру груп, що переносяться, розрізняють метилтрансферази - переносять метильні групи СН3, амінотрансферази - здійснюють перенесення аміяних груп NH2, фосфотрансферази - транспортують залишок фосфатної кислоти.
Гідролази. Ферменти цього класу забезпечують розщеплення внутрішньомолекулярних зв’язків органічних сполук за участі води. До цього класу належить велика група ферментів, у тому числі майже всі ензими шлунково-кишкового тракту: естерази, фосфатази, пептидази та ін.
Ліази. До цього класу відносять ферменти, які каталізують зворотні реакції відщеплення різних груп від субстратів негід- ролітичним шляхом. Розщеплення відбувається за зв’язком С - С, С - N, С - О і т.п. До таких ферментів належать, наприклад, декарбоксилази, які відщеплюють CO2, від карбонових
Ізомерази. Ці ферменти каталізують різні типи реакцій ізомеризації. Вони також каталізують процеси внутрішньомолеку- лярних перетворень: перенесення водню, фосфатних й ацильних груп, зміну просторового розташування атомних груп, переміщення подвійних зв’язків і т.ін. Наприклад, L-ізомери перетворюються на D-ізомери, глюкоза - на фруктозу і т.д.
Лігази, або синтетази. Ферменти цього класу беруть участь в усіх реакціях синтезу різних сполук. Вони прискорюють реакції утворення органічних сполук. Одним із таких природних донаторів енергії є аденозинтрифосфат (АТФ). Енергія, що виділяється при відщепленні залишків фосфорної кислоти, використовується для процесів біосинтезу.
До ферумвмісних ферментів належать каталаза, пероксидаза, цитохромокеидаза.
5. Використання ферментів в харчовій промисловості.
У харчовій промисловості ферменти використовуються для одержання продуктів із заданими властивостями. ГІри цьому можуть використовуватися мікробні ферменти; ферменти, виділені з деяких органів, наприклад печінки, підшлункової залози, шлунка. Більш зручним і ефективним є використання іммобілізованих ферментів.
Іммобілізація ферментів - це включення об’єкта (ферменту) в ізольовану фазу, що відділена від фази вільного розчину, але здатна обмінюватися з нею молекулами.
Іммобілізовані ферменти одержують шляхом зв’язування з носіями розчинних ферментів або клітин, які мають ферментативну активність, тобто чинять сорбцію ферменту на носії і включення в структуру носіїв-гелів.
Іммобілізація наближає умови їх функціонування до природних.
Перевага їх використання полягає в тому, що їх можна видаляти з реакційного середовища, тобто контролювати хід реакції і багаторазово його використовувати. Використання іммобілізованих ферментів дозволяє здійснювати кожен процес безперервно, пропускаючи розчини субстратів через реактори з іммобілізованими ферментами.
Іммобілізовані ферменти мають високу каталітичну активність, її можна змінювати, змінюючи спосіб зв’язування і вид носія. Продукти реакції не забруднюються кристалічними ферментами.
За допомогою іммобілізованих ферментів одержують амінокислоти, ароматичні кислоти, цукри, органічні розчинники, антибіотики, їх використовують для очищення стічних вод і водойм.
У промисловості застосовують ферменти мікробного походження: протеолітичні, ліполітичні, амілолітичні, гідролази, що розщеплюють пектин, целюлозу і геміцелюлозу.
Лекція №8
Вітаміни як компоненти харчування людини.
[1.с.248-289; 2.с.240-284; 4.с.481-501]
План
1. Загальні поняття.
2. Класифікація вітамінів
2.1 Водорозчинні вітаміни
2.2 Жиророзчинні вітаміни
3. Вітамінна недостатність.
1. Загальні поняття.
Вітаміни – біоорганічні сполуки, що є життєво необхідними компонентами обміну речовин; вітаміни не синтезуються в організмі людини як інші біомолекули, а надходять з компонентами харчування. На відміну від таких поживних речовин, як вуглеводи, ліпіди та білки, вітаміни належать до мікрокомпонентів харчування: їх добові потреби для людини складають міліграмові або мікрограмові кількості.
Відкриття вітамінів пов’язане з розробками багатьох дослідників – лікарів, біохіміків, фізіологів, які встановили наявність у продуктах харчування певних сполук, необхідних для нормальної життєдіяльності, - ˝ додаткових факторів харчування ˝. Специфічні хвороби, пов’язані з порушеннями в харчуванні – цинга (скорбут), бері-бері, пелагра, рахіт (˝ англійська хвороба ˝), гемералопія (˝ куряча сліпота ˝) були відомі людству протягом століть. Першим вітаміном, щодо якого було доведено значення як необхідного фактора харчування, був тіамін (вітамін В), отриманий у 1911р. польським дослідником К. Функом з рисових висівок. Сполука, виділена К. Функом, попереджала розвиток бері-бері (поліневриту, спричиненого тривалим споживанням полірованого рису) і містила у своїй структурі аміногрупу, що стало основою запропонованого для всіх додаткових факторів харчування терміна ˝ вітаміни ˝ (vitaminum – амін життя; лат.).
Класифікація вітамінів
Враховуючи, що відкриття перших препаратів вітамінів значно передувало розшифровці їх хімічної структури, історично склалися емпіричні назви (номенклатура) вітамінів, що містять велику літеру латинського алфавіту з цифровим індексом; у сучасних назвах вітамінів вказують також їх хімічну природу, та в деяких випадках – основний біологічний ефект із префіксом ˝ анти- ˝.
Залежно від фізико-хімічних властивостей (розчинності у воді чи в ліпідах) вітаміни поділяють на дві великі групи: водорозчинні та жиророзчинні.
2.1 Водорозчинні вітаміни
Вітамін В₁ (тіамін; антиневритний вітамін).
Вітамін В₂ (рибофлавін).
Вітамін РР (вітамін В₃; ніацин; антипелагричний вітамін).
Вітамін В₆ (піридоксин; антидерматичний вітамін).
Вітамін В₁ ₂ (кобаломін; антианемічний вітамін).
Фолієва кислота (птероїлглутамат; антианемічний вітамін).
Вітамін Н (біотин; антисеборейний вітамін).
Пантотенова кислота (вітамін В₅; антидерматичний вітамін).
Вітамін С (аскорбінова кислота).
Вітамін Р (вітамін проникності).
2.2 Жиророзчинні вітаміни
Вітамін А (ретинол; аксерофтол; вітамін росту).
Вітамін К (філохінон; антигеморагічний вітамін).
Вітамін Е (α - токоферол; вітамін розмноження).
Вітамін F (комплекс поліненасичених жирних кислот).
Вітамін D (кальциферол; антирахітний вітамін).
Вітамінна недостатність.
Вітамінна недостатність - стан, що розвивається внаслідок зменшення (або відсутності) певного вітаміну в організмі. Вітамінна недостатність супроводжується важкими розладами біохімічних та фізіологічних процесів і виникненням специфічної патології.
Розрізняють гіповітамінози та авітамінози – патологічні стани, для яких властивими є, відповідно, відносна або повна недостатність вітаміну в тканинах. Основними причинами виникнення станів вітамінної надостатності (гіпо- та авітамінозів) є:
1.Зменшення (або відсутність) надходження певного вітаміну в організм у складі продуктів харчування (внаслідок нераціональної дієти або неправильної кулінарної обробки харчових продуктів); такі стани отримали назву екзогенних гіпо-(а-)вітамінозів.
2.Порушення засвоєння певних вітамінів клітинами організму (внаслідок розладів їх всмоктування у травному тракті або неспроможності біохімічних систем організму включати вітамін в обмінні процеси, зокрема внаслідок наявності їх структурних конкурентів – антивітамінів) – ендогенні гіпо-(а-)вітамінозів.
3. Збільшене виведення вітамінів в організму або підвищенна їх утилізація в біохімічних та фізіологічних процесах (ситуації, що можуть мати місце при лактації, вагітності, виснажливій фізичній праці, знаходженні людини в екстремальних температурних умовах, при тяжких інфекційних хворобах тощо).
В умовах гіпо- та авітамінозів виникають глибокі порушення певних метаболічних процесів та клітинних функцій, в яких беруть участь вітаміни як специфічні біомолекули. За механізмом дії вітаміни є коферментами складних ферментів (або беруть участь у синтезі коферментів як їх складові компоненти), входять до складу біомембран, виконують певні регуляторні функції на рівні окремих клітинних структур та цілого організму.
|
|