
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Будова молекул
|
|
При поглинанні атомом додаткової (надлишкової) енергії можливий перехід атома у збуджений стан. Тоді у разі збудження один зі спарених електронів атома переходить на підрівень з вищою енергією. Цей перехід тим легший, чим далі від ядра знаходиться валентний електрон. Оскільки збуджений стан атома нестійкий, електрон не може довго перебувати у такому стані; зворотний перехід електрона супроводжується виділенням енергії.
Для переходу атома у збуджений стан потрібна додаткова енергія, але при утворенні хімічного зв’язку енергія виділяється, тому при збудженні атома енергетично вигідним є перехід електронів на підрівні з більш високою енергією в межах одного рівня. Наприклад, атом Магнію в нормальному стані не має неспарених
|
12Мg 1 s 22 s 22 p 6 3 s 2 B = 0,
тобто його валентність у нормальному стані дорівнює нулю. Однак у сполуці MgBr2 валентність Магнію дорівнює двом. Отже, можна припустити, що в молекулі MgBr2 Магній знаходиться у збудженому стані:
 Mg* … 3 s 13 p 1 B = 2.
Mg* … 3 s 13 p 1 B = 2.
Оскільки обидва зв’язки Мg-Br у молекулі вірогідно рівноцінні, припустимо, що s- i p -орбіталі Магнію під час утворення зв’язку змінюють свої форми та енергії, тобто гібридизуються.
 Гібридизація - це «перетворення», або «змішування» вихідних атомних орбіталей, які відрізняються формою та енергією, унаслідок чого утворюється така сама кількість однакових за формою та енергією атомних орбіталей.
Гібридизація - це «перетворення», або «змішування» вихідних атомних орбіталей, які відрізняються формою та енергією, унаслідок чого утворюється така сама кількість однакових за формою та енергією атомних орбіталей.
Гібридизація атомних орбіталей, вірогідно, здійснюється в момент утворення хімічного зв’язку. Гібридна орбіталь має форму витягнутої гантелі:
Незважаючи на витрати енергії на гібридизацію атомних орбіталей, одержується виграш в енергії внаслідок утворення міцнішого зв’язку та симетричнішого розподілу електронної густини в молекулі.
Сиджвік і Пауелл (1940 р.) уперше припустили, що геометрична конфігурація молекули залежить від розміщення електронних пар на валентних рівнях взаємодіючих атомів. Пізніше було розвинуто теорію відштовхування валентних електронних пар: електронні пари розміщуються на валентному рівні атома таким чином, щоб бути максимально віддаленими одна від одної (наче вони взаємно відштовхуються). Тому тип гібридизації атомних орбіталей центрального атома та їх просторове розміщення зазвичай визначають геометричну форму (конфігурацію) всієї молекули.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Взаємне розташування кількох гібридизованих орбіталей у просторі відносно атомного ядра залежить від їх кількості та відповідає мінімальній енергії всієї молекули. У свою чергу, тип гібридизації А.О. залежить від кількості та типу вихідних атомних орбіталей:
· Під час змішування однієї s- і однієї р -атомної орбіталі відбувається sp -гібридизація (q 2): утворюються дві гібридні орбіталі, розміщені під валентним кутом 180°.
· Під час змішування однієї s- і двох p- атомних орбіталей відбувається sp 2-гібридизація (q 3), при цьому утворюються три гібридні орбіталі, розміщені під
· кутом 120°.
· Під час змішування однієї s- і трьох p- атомних орбіталей відбувається sp 3-гібриди-зація (q 4), в результаті чого утворюються чотири гібридні орбіталі, спрямовані до вершин тетраедра. Кут між ними становить 109, 5о.

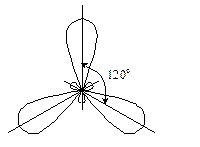

sp -гібридизація А.О. sp 2-гібридизація А.О. sp 3-гібридизація А.О.
7.1. Типи гібридизації атомних орбіталей.
Згідно з експериментальними даними, молекули найчастіше мають неідеальні геометричні форми. Зокрема, у молекулі амоніаку NH3 валентний кут H-N-H становить 107°, а в молекулі води кут H-O-H дорівнює 104, 5°. Причини цих відхилень буде детально розглянуто в Розділі 8.
Молекули речовин можуть бути полярними (диполями) або неполярними. Полярність молекул зумовлена характером розподілу в них електронної густини. В разі симетричного (рівномірного) розподілу електронної густини відносно ядер взаємодіючих атомів утворюються неполярні молекули. У таких молекулах центри позитивних і негативних зарядів збігаються.
Якщо електронна густина в молекулі розподілена несиметрично (нерівно-мірно), то на більш електронегативних атомах зосереджено надлишковий негативний заряд d-, а на менш електронегативних – позитивний d+. У такому випадку електричні центри позитивного і негативного зарядів не збігаються, а розміщені на певній відстані один від одного; тобто утворюється полярна
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
молекула (диполь) з протилежно зарядженими полюсами.
Схематично диполі зображують так:

де l – довжина диполя (відстань між центрами позитивних і негативних зарядів у полярній молекулі).
Полярність двохатомної молекули визначають за допомогою дипольного моменту  (електричного моменту диполя) єдиного зв’язку, що реалізований в молекулі:
(електричного моменту диполя) єдиного зв’язку, що реалізований в молекулі:
 ,
,
де d - ефективний заряд на атомі;  - вектор довжини диполя, який враховує напрям дипольного моменту. Дипольний момент вимірюють у Кулон-метрах або в Дебаях (1D = 3, 33 × 10-30 Кл× м).
- вектор довжини диполя, який враховує напрям дипольного моменту. Дипольний момент вимірюють у Кулон-метрах або в Дебаях (1D = 3, 33 × 10-30 Кл× м).
Для молекул, що складаються з кількох атомів, сумарний дипольний момент визначають як векторну суму дипольних моментів окремих хімічних зв’язків у молекулі. Причому, напрям дипольного моменту умовно позначають від позитивного заряду до негативного. Наявність або відсутність дипольного моменту в молекулі допомагає передбачити геометричну форму молекули. Наприклад, експериментально було визначено, що молекула СО2 неполярна, а молекула SO2 - полярна.Тому можна припустити, що молекула карбону (IV) оксиду, хоча і має  два полярні зв’язки між атомами Оксигену і Карбону, є неполярною внаслідок лінійноїтасиметричноїбудови:
два полярні зв’язки між атомами Оксигену і Карбону, є неполярною внаслідок лінійноїтасиметричноїбудови:
О = С = О  = 0.
= 0.
Для сульфур (IV) оксиду  ¹ 0, оскільки його молекула має кутову
¹ 0, оскільки його молекула має кутову
будову (валентний кут O − S − O становить 119º).
У ряді однотипних кутових молекул, наприклад Н2О, H2S, H2Se, Н2Те, значення дипольних моментів зазвичай зменшуються зі зменшенням різниці електронегативностей елементів (DЕН).
Багато властивостей речовин (наприклад, розчинність, здатність дисоцію-вати в полярних розчинниках тощо) залежать як від полярності окремих зв’язків у молекулі, так і від полярності всієї молекули.
|
|
