
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Міжмолекулярна взаємодія
|
|
Іонний зв’язок - це граничний випадок ковалентного полярного зв’язку. Він утворюється, наприклад, між атомами активних металів і атомами типових неметалів, тобто між елементами, електронегативності яких дуже сильно різняться.
Оскільки при утворенні хімічного зв’язку спільні електрони не можуть повністю переходити до більш електронегативного елемента, а тільки зміщуються до нього, на атомах виникають нецілочислові ефективні заряди (d+ або d−). Зі зменшенням різниці електронегативностей DЕН атомів хімічних елементів частка іонного зв’язку зазвичай зменшується, а ковалентного, навпаки, - збільшується.
Вважають, що при DЕН  1, 8 (за іншими джерелами, при DЕН
1, 8 (за іншими джерелами, при DЕН  1, 9) частка іонного зв’язку більша за 50 відсотків. У цьому випадку атоми умовно розглядають як позитивно і негативно заряджені іони, а зв’язок вважають іонним.
1, 9) частка іонного зв’язку більша за 50 відсотків. У цьому випадку атоми умовно розглядають як позитивно і негативно заряджені іони, а зв’язок вважають іонним.
Початок теорії іонного зв’язку запровадив В. Коссель (1916 р.).
Основні положення теорії іонного зв’язку:
· Під час іонного зв’язку один з двох взаємодіючих атомів віддає електрон і перетворюється на позитивно заряджений іон (катіон), другий атом приєднує електрон і перетворюється на негативно заряджений іон (аніон).
· Іони, що мають протилежні заряди, електростатично притягуються один до одного й утворюють хімічну сполуку з іонним зв’язком.
Утворення іонної сполуки є енергетично вигідним процесом, якщо коли атом, що перетворюється на катіон, має низьку енергію іонізації, а атом, що стає аніоном, – високу енергію спорідненості до електрона.
Оскільки між іонами діють електростатичні сили взаємодії, іонний зв’язок є ненапрямленим і ненасиченим. Ненапрямленість іонного зв’язку зумовлена тим, що електричне поле кожного іона поширюється у просторі рівномірно в усіх напрямках. Ненасиченість іонного зв’язку виявляється в тому, що під час взаємодії двох протилежно заряджених іонів їх електричні поля скомпенсовані неповністю, тому в них є принципова можливість взаємодії цих іонів з іншими. У результаті навколо кожного з іонів розташовані іони протилежного заряду.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Сполуки з іонним зв’язком у вигляді молекул не існують ані в твердому стані, ані в розчині. Нестійкі молекули іонних сполук (наприклад, NaCl) можна виявити тільки в газоподібному стані при високих температурах.
Більшість хімічних елементів у вільному стані - метали. Для них характерні порівняно низькі енергії іонізації атомів, а для відповідних простих речовин - блиск поверхні, високі електро- і теплопровідність, пластичність, ковкість та ін.
Висока тепло- та електропровідність металів зумовлені наявністю в їх кристалах вільних електронів, які рухаються по всьому кристалу. Такий тип зв’язку не можна віднести до іонного або ковалентного. Вважається, що в кристалах металів реалізується особливий металічний хімічний зв’язок.
В атомах металів зазвичай мала кількість валентних електронів, але наявні вакантні (вільні) атомні орбіталі. Крім того, у металічному кристалі атоми розміщені дуже щільно. Через невисокі значення енергій іонізації, характерних для металів, електрони здатні легко відриватися від атомів та можуть переходити з однієї атомної орбіталі на іншу, тобто рухатися у всьому об’ємі кристала. Саме цим пояснюються високі електро- та теплопровідність металів. Можна сказати, що природа металічного зв’язку подібна до ковалентного: також відбувається узагальнення валентних електронів, але металічний зв’язок є делокалізованим і ненапрямленим. Докладніше характерні для металів властивості обґрунтовують за допомогою зонної теорії твердого тіла.
Міжмолекулярні, або вандерваальсові сили (сили Ван-дер-Ваальса) мають електричну природу (тобто підкоряються закону Кулона). Вони діють на більших відстанях, ніж сили хімічного зв’язку, є досить слабкими, оскільки їх енергія набагато менша. Ці сили виникають унаслідок електрохімічного притягання різнойменно заряджених частин сусідніх молекул. Вони зазвичай зумовлюють фізичні властивості (або фізичні взаємодії) речовин. Завдяки міжмолекулярній взаємодії, наприклад, можливий перехід газоподібних речовин у рідкі та кристалічні стани (конденсований стан речовини).
Виділяють наступні основні види міжмолекулярної взаємодії: орієнтаційна, індукційна, дисперсійна та водневий зв’язок.
Орієнтаційна взаємодія зазвичай реалізується між двома або більше диполями.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Індукційна взаємодія реалізується між диполями і неполярними молекулами, унаслідок чого неполярні молекули дещо поляризуються і набувають індукованих дипольних моментів. Індуковані диполі, у свою чергу, взаємодіють з полярними молекулами подібно до орієнтаційної взаємодії, але енергія індукційної взаємодії менша за енергію орієнтаційної взаємодії.
Речовини, які утворені неполярними молекулами (наприклад Н2, Cl2, O2, He, Ne та ін.), під час охолодження можуть переходити в рідкий і, навіть, у твердий стани. Це вказує на наявність міжмолекулярної взаємодії, хоча орієнтаційної взаємодії чи індукційного впливу в них не відбувається. У цих випадках міжмолекулярна взаємодія зумовлена одночасною (синхронною) появою у неполярних молекулах миттєвих диполів. Між ними й виникають сили притягання, які називають дисперсійними (дисперсійна взаємодія). Дисперсійна взаємодія універсальна: вона виникає між будь-якими молекулами незалежно від їх будови, а її енергія зазвичай суттєво менша за енергії орієнтаційної та індукційної взаємодій.
Водневий зв’язок - особливий тип міжмолекулярної взаємодії, який може утворюватись між певними (функціональними) групами у складних молекулах. Він виникає між молекулами, до складу яких входить атом Гідрогену, зв’язаний із сильно електронегативним атомом, наприклад, O, F, Cl, N, S та ін. Природа водневого зв’язку електростатична та частково донорно-акцепторна, оскільки відбувається взаємодія між позитивно поляризованим атомом Гідрогену однієї молекули (акцептор) і негативно поляризованим атомом більш електронегативного елемента іншої молекули (донор). Наприклад, утворення димеру (H-F)2 обумовлено саме водневим зв’язком: 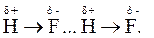
Такий вид зв’язку характеризується просторовою напрямленістю та насиченістю. Енергія водневого зв’язку приблизно на порядок нижча за енергію хімічного зв’язку, але в декілька разів більша за енергію вже розглянутих міжмолекулярних взаємодій. Цей тип зв’язку суттєво впливає на фізичні властивості речовин. Зокрема, високі температури плавлення та кипіння таких речовин як H2O, HF, NH3 обумовлені утворенням їх асоціатів: (H2O)n; (HF)2 тощо.
Як уже зазначалось, водневий зв’язок, характерний для молекул води і зумовлює деякі з так званих аномальних властивостей. У молекулі води два атоми Гідрогену сполучені із сильно електронегативним атомом Оксигену, тоді як дві неподілені електронні пари атома Оксигену здатні утворювати ще два водневі зв’язки із сусідніми молекулами. Це зумовлює тетраедричне розміщення у просторі двох ковалентних і двох водневих зв’язків відносно атома Оксигену, розміщеного в центрі тетраедра.
|
|
