
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Проверка выполнимости закона Фарадея
|
|
РАБОТА l
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Для выделения веществ из растворов применяют электролитические ячейки, называемые электролизерами.
Связь между прошедшим через электролизер количеством электричества и количеством вещества, претерпевшим химическое превращение на электродах, описывается законом Фарадея, согласно которому на каждый Фарадей количества электричества (F), пропущенного через электролитическую ячейку, в электрохимическую реакцию на аноде и на катоде вступает по одному молю эквивалентов вещества. Один Фарадей количества электричества равен 1F = eNA = 96487 Кл, где е – элементарный заряд; NA – число Авогадро. F называется числом Фарадея.
Масса вещества, прореагировавшего на аноде или катоде, равна
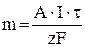 , (1)
, (1)
где А – атомная масса, кг/моль; z – валентность; I – сила тока, А; t – время, с.
Этому уравнению можно придать другую форму, пользуясь понятием об электрохимическом эквиваленте.
m = k·I·t, (2)
где I·t – количество электричества, Кл; k = 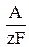 – электрохимический эквивалент, кг/А·с.
– электрохимический эквивалент, кг/А·с.
Если количество электричества выражено в Ампер·часах (1 A·ч = 3600 А·с или Кулонов), тo электрохимический эквивалент равен
k = 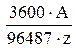 кг/А·ч (3)
кг/А·ч (3)
или k = 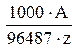 г/А·с. (4)
г/А·с. (4)
Если количество прореагировавшего вещества оказывается меньше, чем следует из закона Фарадея, то, следовательно, на электроде протекает посторонний электрохимическим процесс.
Видимые отклонения от закона Фарадея могут быть связаны также с побочными или нефарадеевскими процессами (дезинтеграцией электрода, выпадением зерен металла из осадка металла, появлением оксидных и гидридных пленок т.п.). Помимо этого, часть промежуточных или побочных продуктов электрохимического процесса может выводиться из зоны реакции. Наиболее часто данное явление наблюдается при совместном выделении на катоде металла и водорода.
Вследствие протекания в электролизерах различных побочных процессов масса выделенного на катоде металла может оказаться меньше, чем следует из закона Фарадея.
Количественно эффективность работы электролизера и отклонения от закона Фарадея выражают величиной выхода по току hТ, которая определяется как отношение количества электричества, пошедшее на осуществление заданного процесса qi к общему количеству электричества, пропущенного через электролитическую ячейку q
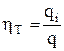 . (5)
. (5)
При осаждении металлов выход по току можно определить отношением массы металла, выделившейся на электроде за определенное время mпр к массе металла, которая должна выделиться за это же время согласно закону Фарадея mтеор.
 . (6)
. (6)
Выход по току обычно выражают в процентах, для этого нужно отношения (5) и (6) умножить на 100.
Важным технико-экономическим показателем работы является величина удельного расхода электроэнергии W:
W = 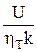 , (7)
, (7)
где U – напряжение на клеммах электролизера, В.
В зависимости от единиц измерения электрохимического эквивалента, удельный расход электроэнергии измеряется в Вт·с/кг, кВт·ч/кг, кВт·ч/т и т.п.
Как один из наиболее точных законов природы, закон Фарадея может быть использован для определения количества электричества, пропущенного через электролитическую ячейку, и составления материального баланса веществ в электродных реакциях.
Для определения точного количества электричества, прошедшего в цепи постоянного тока, применяют специальные электролизеры или электролитические ячейки, называемые кулонометрами, в которых отсутствуют посторонние электрохимические и побочные процессы или вторичные химические реакции. Из кулонометров наиболее точный (0, 005%) – серебряный, но он неудобен в обращении. Титрационный кулонометр Кистяковского и йодный кулонометр также достаточно точны (0, 001%) но применяются для небольших количеств электричества. Во всех случаях, где не требуется большой точности и пропускается относительно большое количество электричества, пользуются медным кулонометром ( 0, 2%).
0, 2%).
Газовый кулонометр менее точен, чем медный ( 0, 5%). Он позволяет следить за ходом окислительно-восстановительных реакций. Сравнением объёмов газов, выделившихся за одинаковое время, можно оценить выход по току за любой промежуток времени, не прерывая электролиза.
0, 5%). Он позволяет следить за ходом окислительно-восстановительных реакций. Сравнением объёмов газов, выделившихся за одинаковое время, можно оценить выход по току за любой промежуток времени, не прерывая электролиза.
Совмещая кулонометр и электрохимическую ячейку, можно определить прошедшее через цепь количество электричества и установить зависимость выхода по току от условий электролиза. При использовании медного кулонометра выход по току находят по привесу катодов электрохимической ячейки и кулонометра.
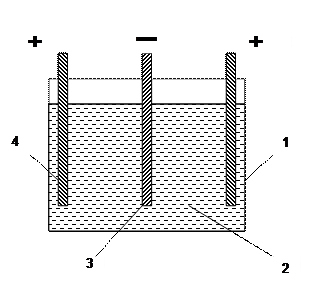
Медный кулонометр (рис.1) состоит из стакана, крышки, двух анодов и катода. В качестве электролита применяют раствор, содержащий на 100 мл воды 15 г сульфата меди и 5 мл этилового спирта или 10 г сахара.
На катоде медного кулонометра протекает реакция восстановления меди:
Cu2+ + 2e = Cu, (8)
а на аноде – реакция окисления меди:
Cu – 2e = Cu2+. (9)
Количество вещества, которое должно выделиться на катоде электрохимической ячейки, рассчитывают по формуле
mтеор = mCu 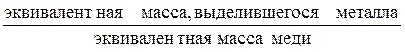 , (10)
, (10)
где mCu – масса меди, выделившаяся на катоде кулонометра.
Перед электролизом катоды промывают, сушат на воздухе при температуре не выше 40 – 50 оС и взвешивают на аналитических весах. Затем катоды крепятся на место, и электрохимическая ячейка и кулонометр готовы к работе. По окончании опыта катоды снова промывают, сушат и взвешивают. Разность результатов двух взвешиваний дает массу осажденных металла и меди.
Общее количество электричества, протекшего через данную цепь в течение опыта, рассчитывают по закону Фарадея, используя значение массы выделившейся меди
 |
q =
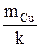 , (11)
, (11)
где q – количество электричества; k – электрохимический эквивалент.
Рис.1. Схема медного кулонометра.
1– сосуд, 2 – электролит, 3 – медный катод, 4 – медные аноды
Газовый кулонометр (рис.2) обычно состоит из стакана и газовой бюретки с впаянными в нее платиновыми электродами, в качестве электролита используют 10 – 20 % раствор едкого натра.
При работе газового кулонометра на катоде выделяется водород, а на аноде – кислород:
2H2O + 2e = 2OH– + H2 , (12)
2OH– = H2O+1/2 O2 + 2e. (13)
В выделяющемся газе на каждую молекулу кислорода приходится две молекулы водорода, поэтому в объеме V газа будет следующее количество молей водорода:
n = 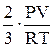 , (14)
, (14)
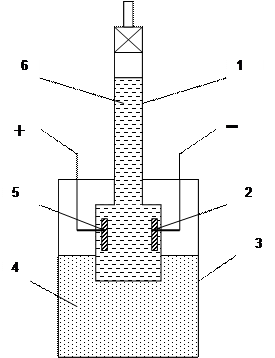 |
Рис.2. Схема газового кулонометра
1 – бюретка; 2 – катод; 3 – сосуд; 4 – электролит; 5 – анод
где Р – общее давление газовой смеси, Па;
V – объем выделившегося газа, м3;
R – универсальная газовая постоянная, Дж/моль·К
Т – температура, К.
Газ, выделяющийся в кулонометре, собирается в газовой бюретке, которая, как правило, заполняется не полностью, поэтому определяемый объем будет равен
V = V2 – V1, (15)
где V2 и V1 – конечный и начальный объемы газа в бюретке, соответственно. Давление газа в бюретке меньше атмосферного на величину упругости водяного пара над раствором и гидростатического давления столба жидкости h, оставшейся в бюретке. С учетом изменения давления на величину указанных поправок объем выделившегося газа приводят к нормальным условиям, используя уравнение
V = 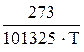 [(P – 0, 125 – Pв)(V2 – V1) – ρ (V2h2 – V1h1)], (16)
[(P – 0, 125 – Pв)(V2 – V1) – ρ (V2h2 – V1h1)], (16)
где Pв – упругость пара воды над раствором, Па;
h1 и h2 – высота начального и конечного столбов раствора в бюретке соответственно, м;
ρ – плотность раствора, кг/м3.
Принимая во внимание уравнения (1) и (2), получаем выражение для расчета числа молей водорода:
n = 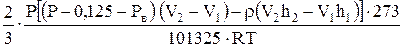 (17)
(17)
Зная число молей водорода, выделившегося в кулонометре, рассчитывают количество электричества, прошедшего через кулонометр, по уравнению
q =  F. (18)
F. (18)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы – определение выхода по току и удельного расхода электроэнергии при осаждении никеля на никелевый катод в различных условиях электролиза с применением медного и газового кулонометров.
Порядок выполнения работы
Работу начинают с подготовки катодов медного кулонометра и электролизера, приготовления необходимых электролитов.
1. Электроды зачищают наждачной бумагой, промывают дистиллированной водой и этиловым спиртом, выдерживают на воздухе в течение 10–15 минут до полного высыхания, взвешивают и помещают в медный кулонометр и в электролизер.
2. Готовят электролиты для медного и газового кулонометров и электролизера.
Состав растворов кулонометров указан выше. Состав электролита электролизера приведен в таблице 1.
Таблица 1. Состав электролита для никелевого электролизера, г/л
| Компонент | NiSO4 безводный | NaCl | H3BO3 | H2SO4 |
| Раствор 1 | ||||
| Раствор 2 |
3. Заполняют электролитами кулонометры и электролизер. Фиксируют объем газа в бюретке газового кулонометра.
4. Собирают установку, схема которой представлена на рис. 3.
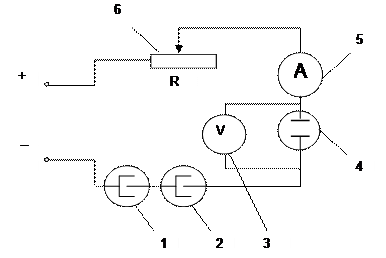 |
Рис.3. Схема электрохимической цепи для определения выхода по току и удельного расхода электроэнергии при выделении никеля из водного раствора электролита.
1 – газовый кулонометр; 2 – медный кулонометр; 3 – вольтметр; 4 – электролизер; 5 – амперметр; 6 – переменное сопротивление для установления силы тока
5. После сборки схемы замыкают цепь. Электролиз проводят и течение часа при плотности тока 20 мА/см2 и температуре 18–25 оС. Во время электролиза фиксируют силу тока в цепи и напряжение на электролизере.
6. Извлекают никелевый и медный электроды из электролизера и кулонометра, промывают водой, сушат и взвешивают.
7. Фиксируют объем газа в бюретке газового кулонометра.
Обработка результатов опыта
1. Рассчитывают увеличение массы никелевого электрода и катода медного кулонометра.
2. Рассчитывают увеличение объема газа в бюретке газового кулонометра.
3. По привесу катода медного кулонометра и увеличению объема газа в бюретке газового кулонометра рассчитывают количество электричества, затраченное на электролиз.
4. Рассчитывают среднее количество электричества по данным, полученным с обоих кулонометров.
5. Рассчитывают выход по току и удельный расход электроэнергии, используя уравнения (6) и (7).
Результаты измерений и расчетов записывают в таблицу.
Таблица 2. Результаты эксперимента.
| Сила тока, А | Напряжение на электролизере, В | Время электролиза, с | mmCu, г | mmNi, г | H2, моль | qqCu Кл | qqгаз, Кл | Выход по току, % | Удельный расход электроэнергии, кВт·ч/т |
По результатам работы делают выводы и вычисляют абсолютную и относительную ошибки.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какова связь константы Фарадея (F) и числа Авогадро (NA)?
2. Как можно рассчитать электрохимический эквивалент вещества (элемента), выразив его в г/Кл или кг/А·ч?
3.Как влияют условия электролиза на выход по току?
4.Какое практическое применение находят законы Фарадея?
5. Какова причина отсутствия тока в цепи, если источник питания исправен и обрыва цепи нет?
6. Дать понятие выхода по току.
7. Причины отклонения выхода по току от 100 %.
8. Как рассчитать удельный расход электроэнергии?
9. Как рассчитать количество электричества, затраченное на электролиз, с помощью медного кулонометра?
10. Как рассчитать количество электричества, затраченное на электролиз, с применением газового кулонометра?
11. Влияет ли температура на выход по току и удельный расход электроэнергии и если влияет, то как?
12. Каковы размерности величин в уравнениях?
|
|
