
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример.
|
|
Вычислите температуры кристаллизации и кипения 2% водного раствора глюкозы (С6Н12О6).
Решение: Согласно 2 закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (Δ t) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением:
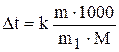 , (1)
, (1)
где k-криоскопическая или эбуллиоскопическая постоянная.
Для воды они соответственно равны 1, 86 и 0, 52о (таблица 23);
M и m – соответственно масса растворенного вещества и его мольная масса;
m1 – масса растворителя.
Понижение температуры кристаллизации 2% раствора глюкозы С2Н12О6 находим из формулы (1).
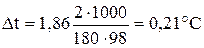 .
.
Вода кристаллизируется при 0оС, следовательно, температура кристаллизации равна 0 – 0, 21= – 0, 21оС.
Из формулы (1) находим и повышение температуры кипения 2% раствора
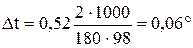
Вода кипит при 100оС, следовательно, температура кипения этого раствора 100 + 0, 06 оС = 100, 6оС.
Контрольные задания.
Решите задачи, приведенные в таблице 8. Дайте полное объяснение хода решения, используя таблицу 23.
Таблица 8
| № | Условие задания | Ответы |
| Вычислите осмотическое давление раствора, содержащего 16 г сахарозы (С12Н22О11) в 350 г воды при 293 К. Плотность раствора считать равной единице. | 5, 77 кПа | |
| При 25оС осмотическое давление раствора, содержащего 2, 8 г высокомолекулярного органического вещества в 200 см 3 раствора равно 0, 07 кПа. Определите молярную массу растворенного вещества. | 48 г/моль | |
| При 315 К давление насыщенного пара над водой равно 8, 2 кПа. На сколько понизится давление пара при указанной температуре, если в 100 г воды растворить 36 г глюкозы (С6Н12О6)? | на 54 Па | |
| На сколько градусов повысится температура кипения воды, если в 100 г воды растворить 9 г глюкозы (С6Н12О6)? | на 0, 26º C | |
| При растворении 5 г вещества в 200 г воды получается не проводящий тока раствор, кристаллизующийся при (–1, 45 оС). Определите массу растворенного вещества. | 32 г/моль | |
| Раствор, содержащий 5, 4 г неэлектролита в 200 г воды, кипит при 100, 078 оС. Вычислите мольную массу растворенного вещества. | 28 г/моль | |
| Вычислите массовую долю водного раствора сахара (С12Н22О11), зная, что температура кристаллизации раствора равна (–0, 93 оС). | 14, 6% | |
| Вычислите температуру кристаллизации раствора, содержащего 5 г мочевины (NH2)2CO в 150 г воды. | –1, 03º C |
| Раствор, содержащий 3, 04 г камфоры (С10Н16О) в 100 г бензола кипит при 80, 7 оС. Температура кипения бензола 80, 20 оС. Вычислите его эбуллиоскопическую константу. | 2, 57º | |
| Вычислите процентную концентрацию водного раствора глицерина (С3Н5(ОН)3), зная, что этот раствор кипит при 100, 39 оС. | 6, 45% | |
| Раствор, полученный при растворении 2, 25 г неэлектролита в 250 см3 воды кристаллизируется при 0, 279 оС. Вычислите молярную массу неэлектролита. | 60 г/моль | |
| Вычислите температуру кипения 5% раствора камфоры (С10Н16О) в бензоле, если температура кипения бензола равна 80, 2 оС. | 81, 25º C | |
| Раствор, содержащий 25, 65 г некоторого неэлектролита в 300 г воды кристаллизируется при (-0, 465 оС). Вычислите моляльную массу растворенного вещества, если криоскопическая константа воды 1, 86 оС. | 342 г/моль | |
| Вычислите криоскопическую константу уксусной кислоты, зная что раствор содержащий 4, 25 г антрацена (С14Н10) в 100 г уксусной кислоты, кристаллизируется при 15, 718 оС. Температура кристаллизации уксусной кислоты 16, 65 оС. | 3, 9º С | |
| При растворении 4, 86 г серы в 60 г бензола температура кипения его повысилась на 0, 81 оС. Сколько атомов содержит молекула серы в этом растворе. | ||
| Температура кристаллизации раствора, содержащего 66, 3 г некоторого неэлектролита в 500 г воды равна (-0, 58 оС). Вычислите молярную массу растворенного вещества. | 342 г/моль | |
| Какую массу анилина (С6Н5NН2) следует растворить в 50 г бензола, чтобы температура кипения раствора была выше температуры кипения бензола на 0, 53 оC? | 1, 16 г | |
| Вычислите температуру кристаллизации 2% раствора этилового спирта (С2Н5ОН). | 81, 25º C | |
| Сколько грамм мочевины ((NH2)2CO) следует растворить в 75 г воды, чтобы температура кристаллизации раствора понизилась на 0, 465 оС. | 1, 16 г | |
| Вычислите массовую долю глюкозы (С6Н12О6) в растворе, зная, что он кипит при 100, 26 оС. | 8, 25% |
|
|
