
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Электролиз
|
|
Окислительно-восстановительные процессы, протекающие на электродах при пропускании электрического тока через раствор или расплав электролита, называются электролизом. При этом на катоде происходит процесс восстановления, а на аноде - процесс окисления.
При электролизе могут быть использованы два типа анодных электродов: активные (расходуемые) и инертные (нерасходуемые). Активный анод окисляется, переходя в раствор в виде ионов, а инертный является только электродом, через который в раствор (или расплав) передаются электроны. Инертные электроды обычно изготовляют из графита или платины.
Рассмотрим, например, электролиз расплава соли CdCl2. При плавлении происходит электролитическая диссоциация соли:
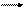 CdCl2 Cd2+ + 2Cl-.
CdCl2 Cd2+ + 2Cl-.
Если теперь в сосуд, содержащий это вещество, опустить два инертных электрода из графита и подключить их к полюсам внешнего источника тока, то в электролите начнется направленное движение ионов. При этом на катоде будет происходить восстановление ионов кадмия, а на аноде - окисление ионов хлора:
катод: Cd2+ + 2ē = Cdо ;
анод: 2Cl- – 2ē = Cl2.
Cd2+ + 2Cl- = Cdо + Cl2 суммарная реакция.
Через некоторое время на катоде осаждается металлический кадмий, а на аноде будет выделяться газообразный хлор (в виде пузырьков). При этом инертные электроды превратятся в активные - в кадмиевый и хлорный, соответственно, имеющие следующие стандартные электродные потенциалы:
Cd2+ + 2ē = Cdо; jо = -0, 4 В,
Cl2.+ 2ē = 2Cl-; jо = +1, 36 В.
Возникшему ГЭ будет соответствовать токообразующая реакция, обратная электролизу:
Сd + Cl2 = CdCl2.
Как видно из величин и знаков этих потенциалов, возникшая ЭДС направлена навстречу внешнему источнику напряжения при электролизе. Следовательно, минимальное напряжение (напряжение разложения), которое необходимо приложить для электролиза, определяется ЭДС гальванического элемента (ГЭ), возникающего в этом процессе. В данном случае
ЭДСо = 1, 36 - (-0, 4) = 1, 76 В.
Эта величина, однако, найдена для стандартных условий, которые часто не выполняются (нарушаются) при электролизе. Отклонение напряжения электролиза (и ЭДС ГЭ) от стандартного значения называется поляризацией.
Последовательность электродных процессов. В рассмотренном выше примере электролиза расплава CdCl2 в электролите имелись только один вид катионов и анионов. Однако часто на практике в электролите присутствуют несколько видов ионов или недиссоциированных молекул.
В тех случаях, когда на одном и том же электроде возможно протекание двух (или большего числа) процессов, наиболее вероятен тот, осуществление которого требует меньшей затраты энергии. Это правило вытекает из законов термодинамики.
В частности, порядок разрядки ионов на электродах из смеси (раствора) при ее электролизе определяется потенциалом соответствующего электрода с учетом поляризации: первым на катоде выделяется (разряжается) тот ион, потенциал которого больше; на аноде в первую очередь разряжаются (окисляются) ионы, потенциал которых меньше.
Так как существует поляризация, то определять порядок разрядки ионов на электродах по стандартным значениям потенциалов нельзя, нужно знать экспериментальные значения потенциалов при определенных условиях. Установлено, что перенапряжение при разрядке ионов металлов на катоде наименьшее, поэтому они ведут себя при электролизе приблизительно в соответствии с их стандартными потенциалами. Наибольшее перенапряжение имеет место при разрядке сложных ионов (NO3-, SO42- и др.), а также на газовых электродах (водородном, кислородном).
В соответствии с экспериментальными данными для катодного восстановления при электролизе водных растворов электролитов сформулированы качественные правила для электролиза разбавленных растворов солей, которые учитывают тот факт, что в растворе соли, кроме ее собственных ионов, имеются ионы и молекулы самой воды (Н2О. Н+, ОН-), которые также могут участвовать в электролизе.
|
|
