
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Типы окислительно-восстановительных реакций
|
|
Различают три типа окислительно-восстановительных реакций:
1. Межмолекулярные окислительно-восстановительные реакции, при которых изменяются степени окисления атомов элементов, входящих в состав разных веществ. Реакции, рассмотренные в примерах 3-5, относятся к этому типу.
2. Внутримолекулярные окислительно-восстановительные реакции, при которых степень окисления изменяют атомы разных элементов одного и того же вещества. По такому механизму протекают реакции термического разложения соединений. Например, в реакции
+5 -2 +4 0
Pb(NO3)2 ® PbO + NO2 + O2
изменяет степень окисления азот (N+5 ® N+4) и атом кислорода (О-2 ® О20), находящиеся внутри молекулы Pb(NO3)2.
 восстановитель 2 2N+5 ® 2N+4, Dw = –2 процесс восстановления,
восстановитель 2 2N+5 ® 2N+4, Dw = –2 процесс восстановления,
окислитель 1 2O–2 ® O20, Dw = +4 процесс окисления.
Составляем уравнение реакции: 2Pb(NO3)2 = 2PbO + 4NO2 + O2
3. Реакции самоокисления-самовосстановления (диспропорционирования, дисмутации). В этом случае степень окисления одного и того же элемента и повышается, и понижается. Реакции диспропорционирования характерны для соединений или элементов веществ, соответствующих одной из промежуточных степеней окисления элемента.
Пример 6. Используя метод баланса, уравнять реакцию:
K2MnO4 + H2O ® KMnO4 + MnO2 + KOH.
Решение Определим степени окисления участвующих в окислительно-восстановительном процессе элементов до и после реакции:
+6 +7 +4
K2MnO4 + H2O ® KMnO4 + MnO2 + KOH.
Из сравнения степеней окисления следует, что марганец одновременно участвует в процессе окисления, повышая степень окисления с +6 до +7, и в процессе восстановления, понижая степень окисления с +6 до +4.
 2 Mn+6 ® Mn+7; Dw = 7-6 = +1 (процесс окисления, восстановитель),
2 Mn+6 ® Mn+7; Dw = 7-6 = +1 (процесс окисления, восстановитель),
1 Mn+6 ® Mn+4; Dw = 4-6 = -2 (процесс восстановления, окислитель).
Поскольку в данной реакции окислителем и восстановителем выступает одно и то же вещество (K2MnO4), коэффициенты перед ним суммируются. Записываем уравнение:
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4KOH.
В этом случае K2MnO4 является одновременно и окислителем, и восстановителем.
4. Внутримолекулярные реакции окисления-восстановления, в которых происходит выравнивание степеней окисления атомов одного и того же элемента (то есть обратные ранее рассмотренным), являются процессами контрдиспропорционирования (коммутации), например
-3 + 3 0
NH4NO2 ® N2 + 2H2O.
 |
1 2N-3 - 6ē ® N20 (процесс окисления, восстановитель),
1 2N+3 + 6ē ® N20 (процесс восстановления, окислитель).
Наиболее сложными являются окислительно-восстановительные реакции, в которых окислению или восстановлению подвергаются одновременно атомы или ионы не одного, а двух или нескольких элементов.
Пример 7. Используя вышеизложенные положения, уравнять реакцию:
+3 -2 +5 +5 +6 +2
As2S3 + HNO3 ® H3AsO4 + H2SO4 + NO.
 | |||
 | |||

 3 2As+3 - 4ē ® 2As+5 28
3 2As+3 - 4ē ® 2As+5 28
 3S-2 - 24
3S-2 - 24 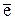 ® 3S+6 (процесс окисления),
® 3S+6 (процесс окисления),
28 N+5 + 3 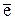 ® N+2 (процесс восстановления).
® N+2 (процесс восстановления).
Суммируем левые и правые части с учетом полученных коэффициентов и записываем уравнение:
3As2S3 + 28HNO3 + 4H2O = 6H3AsO4 + 9H2SO4 + 28NO.
|
|
