
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Химические источники электрической энергии
|
|
Понятие об электродном потенциале. Если металлическую пластинку опустить в воду или раствор, содержащий ионы этого металла, то на границе раздела металл-раствор за счет процессов растворения-осаждения металла возникает разность или скачок потенциала, который зависит от природы металла, концентрации раствора, а также от температуры. Этот скачок называется электродным потенциалом данного металла. Указанное равновесие выражается уравнением, учитывающим гидратацию иона:
Ме + mH2O ⇆ Me n+(H2O)m + nē.
в растворе на металле
Потенциал, соответствующий данному равновесию, называется равновесным электродным потенциалом.
Значение j нельзя определить по абсолютной величине. Поэтому потенциалы всех электродов определяют по отношению к стандартному водородному электроду, потенциал которого принимают равным нулю:
jо298 (2Н+ ® Н2) = 0.
Потенциалы, определенные относительно стандартного электрода в стандартных условиях (то есть jо298) табулированы. Для металлов по химическим данным (Н.Н. Бекетовым), а затем путем измерения jо298 установлен ряд активности металлов (ряд напряжений), (табл. 10.1).
Электродный потенциал, измеренный при стандартных условиях
(Т = 298К; [Mеn+] = 1моль/л) относительно стандартного водородного электрода, называется стандартным электродным потенциалом металла и обозначается j0. Стандартный электродный потенциал является количественной характеристикой химической активности металла, т.е. его способности отдавать свои валентные электроны и переходить в раствор в виде ионов.
Чем меньше величина j, тем сильнее выражена восстановительная активность металла и тем меньшие окислительные способности проявляют его ионы, и наоборот.
Если условия отличаются от стандартных, то для расчета электродного потенциала используется формула Нернста:
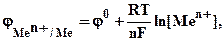 (10.1)
(10.1)
где jо - стандартный электродный потенциал металла,
n - число электронов, принимающих участие в процессе,
F - постоянная Фарадея (96500 Кл/моль),
R - универсальная газовая постоянная (8, 31 Дж·моль-1·К-1),
Т – абсолютная температура (К).
Таблица 10.1
Стандартные электродные потенциалы j0 некоторых металлов
(ряд напряжения)
| Электрод | j 0, В | Электрод | j 0, В | Электрод | j 0, В |
| Li+/Li | -3, 04 | Mn2+/Mn | -1, 18 | 2H+/H2 | 0, 00 |
| Rb+/Rb | -2, 93 | Cr2+/Cr | -0, 91 | Sb3+/Sb | +0, 20 |
| K+/K | -2, 93 | Zn2+/Zn | -0, 76 | Bi3+/Bi | +0, 21 |
| Сs+/Cs | -2, 91 | Cr3+/Cr | -0, 74 | Cu2+/Cu | +0, 34 |
| Ba2+/Ba | -2, 90 | Fe2+/Fe | -0, 44 | Сu+/Cu | +0, 52 |
| Ca2+/Ca | -2, 87 | Сd2+/Cd | -0, 40 | Hg22+/2Hg | +0, 79 |
| Na+/Na | -2, 71 | Сo2+/Co | -0, 27 | Ag+/Ag | +0, 80 |
| Mg2+/Mg | -2, 37 | Ni2+/Ni | -0, 25 | Hg2+/Hg | +0, 85 |
| Al3+/Al | -1, 70 | Sn2+/Sn | -0, 14 | Pt2+/Pt | +1, 19 |
| Ti2+/Ti | -1, 63 | Pb2+/Pb | -0, 13 | Au3+/Au | +1, 50 |
| Zr4+/Zr | -1, 58 | Fe3+/Fe | -0, 04 | Au+/Au | +1, 70 |
Если в приведенном уравнении заменить постоянные числовыми значениями, то оно примет следующий вид:
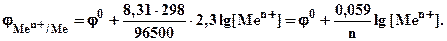 (10.2)
(10.2)
Из выражений (10.1) и (10.2) видно, что при стандартной концентрации катионов, равной 1 моль/л j = jо, т.е. равновесный электродный потенциал металла равен его стандартному потенциалу.
Гальванический элемент Даниэля-Якоби. Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникает направленное движение электронов - электрический ток.
Рассмотрим систему, в которой два электрода находятся в растворах своих солей. Примером может служить гальванический элемент Даниэля-Якоби (10.1). Он состоит из медной и цинковой пластинок, опущенных в растворы своих солей. На поверхности цинковой пластинки устанавливается равновесие Zn ⇆ Zn2+ + 2ē, которому соответствует потенциал jо = -0, 76 В (табл. 10.1). На поверхности медной пластинки устанавливается равновесие Cu ⇆ Cu2+ + 2ē, которому соответствует равновесный потенциал jо = +0, 34 В
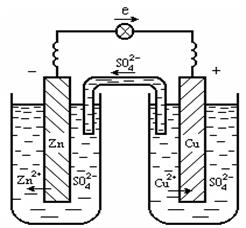
Рис. 7.1. Медно-цинковый гальванический элемент:
(1 - цинковый электрод - анод; 2 - медный электрод - катод; 3 - ионный
ключ- электролит, проводящий ионы SO42-; 4 - электронный проводник)
Устройства, в которых на электродах самопроизвольно протекают окислительно-восстановительные реакции, в результате которых получается электрическая энергия, называются гальваническими элементами. Электрод, на котором протекает процесс окисления, называется анодом; другой электрод, на котором осуществляется процесс восстановления, называется катодом.
Потенциал цинкового электрода имеет более отрицательное значение, поэтому при замыкании внешней цепи электроны будут переходить от цинка (анод) к меди (катод). В результате этого процесса равновесие на аноде (Zn) сместится вправо и в раствор перейдет дополнительное количество ионов цинка (происходит растворение анода). В то же время равновесие на медном электроде сместится влево и произойдет выделение меди на катоде.
Схема гальванического элемента записывается следующим образом:
(-) Zn½ Zn2+║ Cu2+½ Cu (+).
(А): Zn - 2ē = Zn2+, (окисление)
(К): Cu2+ + 2ē = Cu0, (восстановление)
Zn + Cu2+ = Zn2+ + Cu.
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей. В результате этой химической реакции в Г.Э. возникает движение электронов во внешней цепи и ионов в растворе.
Электродвижущая сила гальванического элемента (ЭДС). Электрическая работа, получаемая с помощью гальванического элемента, будет максимальной, когда элемент работает в условиях, наиболее близких к обратимым. Максимальная разность потенциалов электродов данного гальванического элемента, которая определяется в условиях равновесия, называется его электродвижущей силой (ЭДС). Она равна разности равновесных потенциалов катода и анода элемента. При стандартных условиях:
ЭДС о = D jо = jо катода - jо анода. (10.3)
Пример 1. Вычислить ЭДС гальванического элемента, составленного из магниевого и свинцового электродов, в котором [Mg2+] = 0, 1 M; [Pb2+] = 0, 001 M.
Решение. jо Mg2+/Mg = -2, 37 В; jо Pb2+/Pb = -0, 13 B (табл. 10.1); jо магниевого электрода меньше, т.е. Mg является более активным металлом, поэтому в гальваническом элементе магний будет анодом, а свинец - катодом. На электродах будут протекать следующие процессы:
А: Mg - 2e = Mg2+,
К: Pb2+ + 2e = Pbо .
Схема гальванического элемента записывается так: Mg½ Mg2+║ Pb2+½ Pb.
Для расчета ЭДС необходимо найти электродные потенциалы. Согласно уравнению Нернста (10.2):
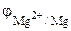 = jо +
= jо + 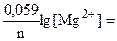 -2, 37 + 0, 0295.lg 0, 1 = -2, 4 B;
-2, 37 + 0, 0295.lg 0, 1 = -2, 4 B;
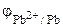 = -0, 13 + 0, 0295.lg 0, 001 = -0, 13 + 0, 0295·(-3) = -0, 22 В.
= -0, 13 + 0, 0295.lg 0, 001 = -0, 13 + 0, 0295·(-3) = -0, 22 В.
ЭДС = jкат - jан = -0, 22 - (-2, 4) = 2, 18 В.
Пример 2. Определить ЭДС гальванического элемента, составленного из серебряных электродов, опущенных в 0, 0001 М и 0, 1 М растворы AgNO3.
Решение. Гальванический элемент может быть составлен не только из различных, но и одинаковых электродов, погруженных в растворы одного и того же электролита различной концентрации (концентрационные элементы). Найдем электродные потенциалы по формуле Нернста (10.2):
j1Ag+ / Ag = jо + 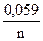 ·lg[Ag+] = 0, 8 + 0, 059·lg0, 001 = 0, 8 + 0, 059·(-3) = 0, 62 В,
·lg[Ag+] = 0, 8 + 0, 059·lg0, 001 = 0, 8 + 0, 059·(-3) = 0, 62 В,
j2 Ag+ / Ag = 0, 8 + 0, 059·lg0, 1 = 0, 8 - 0, 059 = 0, 74 В.
Поскольку j1 < j2, электрод, опущенный в 0, 001 М раствор, будет являться анодом:
ЭДС = jкат - jан = 0, 74 - 0, 62 = 0, 12 В.
Схема такого гальванического элемента записывается так:
(-) Ag½ AgNO3(0, 001М) ║ AgNO3(0, 1М)½ Ag (+).
Как уже было показано на примере водородного электрода, электроды, а, следовательно, и гальванические элементы могут быть созданы не только для реакции окисления-восстановления металлов, но и для любых веществ и окислительно-восстановительных реакций, происходящих в растворах или расплавах.
Как и при любых самопроизвольно протекающих процессах, реакция, протекающая в Г.Э., сопровождается уменьшением энергии Гиббса
DG = -n× F× Dj, (10.4)
где F - постоянная Фарадея (заряд, переносимый одним молем элементарных зарядов (F = 96485, или»96500Кул/моль экв);
n - заряд, переносимый одной частицей (для Zn2+ и Cu2+ n = 2);
Dj = jкатода - jанода = jок-ля - jвосст-ля.
Таким образом, разность потенциалов на электродах можно не только непосредственно измерить, но и вычислить из чисто химических экспериментальных данных.
Для увеличения ЭДС можно сделать следующее:
1. В качестве электродов выбрать металлы с наибольшей разностью потенциалов;
2. Уменьшить концентрацию анодного электролита и увеличить концентрацию катодного.
|
|
