
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Уравнивание ОВР
|
|
Рассмотрим некоторые методы составления уравнений для реакций окисления-восстановления.
Метод баланса степеней окисления. Для нахождения коэффициентов учитывают правило, согласно которому суммарное изменение степеней окисления окислителя и восстановителя в реакции равно нулю; то есть повышение степени окисления восстановителя равно ее понижению у окислителя.
Пример 3. Составьте уравнение окислительно-восстановительной реакции:
+7 +3 +2 +5
KMnO4 + H3PO3 + H2SO4 ® MnSO4 + H3PO4 + K2SO4 + H2O.
Решение. Определяем, как изменяют свою степень окисления восстановитель и окислитель, и отражаем это в уравнениях:
 восстановитель 5 P+3 ® P+5, Dw = (+5) - (+3) = +2 процесс окисления,
восстановитель 5 P+3 ® P+5, Dw = (+5) - (+3) = +2 процесс окисления,
окислитель 2 Mn+7 ® Mn+2, Dw = (+2) - (+7) = -5 процесс восст-ния.
Коэффициенты перед веществами, атомы которых не меняют свою степень окисления, находят подбором. Уравнение реакции будет иметь следующий вид:
2КMnO4 + 5H3PO3 + 3H2SO4 = 2MnSO4+ 5H3PO4 + K2SO4 + 3H2O.
Пример 4. Составьте уравнение реакции взаимодействия цинка с концентрированной серной кислотой, принимая максимальное восстановление последней.
Решение. Цинк, как любой металл, проявляет только восстановительные свойства. В концентрированной серной кислоте окислительную функцию несет сера в степени окисления (+6). Максимальное восстановление серы означает, что она приобретает минимальную степень окисления. Минимальная степень окисления серы как р- элемента VI А группы равна -2. Цинк, как металл II В группы, имеет постоянную степень окисления +2. Отражаем сказанное в уравнениях:
 восстановитель 4 Zn ® Zn+2, Dw = +2 процесс окисления,
восстановитель 4 Zn ® Zn+2, Dw = +2 процесс окисления,
окислитель 1 S+6 ® S-2, Dw = -8 процесс восстановления.
Составляем уравнение реакции: 4Zn + 5H2SO4= 4ZnSO4 + H2S+ 4H2O.
Перед H2SO4 стоит коэффициент 5, а не 1, так как еще четыре моля кислоты идут на связывание четырех ионов Zn2+ (то есть H2SO4 - и окислитель, и среда реакции). Далее по балансу атомов водорода определяют количество (моль) воды. Для проверки правильности подобранных коэффициентов подсчитывают баланс кислорода.
При повышении степени окисления протекает процесс окисления, а само вещество является восстановителем. При понижении степени окисления протекает процесс восстановления, а само вещество является окислителем.
Описанный метод уравнивания ОВР носит название “метод баланса по степеням окисления”.
–1 –1 0 –2
Пример 5. Уравнять реакцию: KI + H2O2 + H2SO4 ® I2 + K2SO4 + H2O.
Решение. Изменение степени окисления претерпевают иод и кислород. Составляем уравнения баланса:
 1 2I- - 2
1 2I- - 2 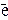 = I2 ,
= I2 ,
1 2O–1 + 2 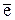 = 2O–2.
= 2O–2.
Конечное уравнение: 2KI + H2O2 + H2SO4 = I2 + K2SO4 + 2H2O.
|
|
