
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Лабораторна робота 2
|
|
ВИЗНАЧЕННЯ ФІЗИЧНИХ КОНСТАНТ ОРГАНІЧНИХ СПОЛУК
Контрольні питання
1. Чому парафіни нормальної (нерозгалуженої) будови мають більш високу температуру плавлення, ніж парафіни ізомерної будови з тим же числом атомів вуглецю?
2. Чому у стерео ізомерних сполук транс-ізомер має більш високу температуру плавлення?
3. Як змінюється температура плавлення речовини із збільшенням степені асоціації молекул?
4. Як змінюється температура плавлення речовини при заміщенні атома водню на атом галоїду, гідроксильну, карбоксильну або аміногрупу?
5. Чому в ароматичному ряду з дизаміщених похідних бензолу найбільш високу температуру плавлення мають п- ізомери, а серед тризаміщених при більш високій температурі плавляться 1, 3, 5-похідні?
6. Що таке криві кристалізації або криві плавлення?
7. Методи визначення температури плавлення.
8. Що таке температура кипіння рідини?
9. Як змінюється температура кипіння в гомологічних рядах (аліфатичних та ароматичних) сполук при введенні в молекулу однієї групи -СН2-?
10. Які сполуки в аліфатичному ряду мають більш високу температуру кипіння: нормальні чи з розгалуженим ланцюгом вуглецевих атомів? Чому?
11. Чому в ароматичному ряду при більш високій температурі киплять орто-ізомери?
12. Розрахунок температури кипіння речовини за емпіричним рівнянням.
13. Методи визначення температури кипіння.
14. Що таке показник заломлення світла?
15. Яке явище лежить в основі методу визначення показника заломлення за допомогою рефрактометра? Правила роботи з рефрактометром.
Кожна органічна сполука характеризується постійними фізичними властивостями в певних умовах (температурі і тиску). З цих фізичних властивостей легше за все визначаються і, як правило, наводяться в хімічній літературі при опису окремих сполук такі: температура плавлення, температура кипіння, показник заломлення, густина, ультрафіолетові (УФ-), інфрачервоні (ІЧ-) та ядерно-магнітного резонансу (ЯМР-) спектри. Найбільш просто встановити тотожність невідомої сполуки з відомою (ідентифікація), а також доказати його чистоту – визначити його фізичні константи та порівняти їх з тими, що наведені в літературі.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
За даними про хімічний склад та фізичні властивості можна також судити про чистоту речовини.
2.1. Температура плавлення та її визначення
Принцип методу: Температурою плавлення речовини називають температуру рівноваги фаз тверда речовина - рідина під час процесу плавлення. Визначити цю температуру можна в процесі плавлення або в процесі застигання розплаву тому, що, якщо виключено переохолодження, температура застигання співпадає з температурою плавлення.
Часто за температуру плавлення приймають інтервал температур між появою перших крапель рідини і повним переходом твердої речовини в рідкий стан. Для чистих індивідуальних сполук цей інтервал вимірюється частками градуса. В присутності домішок точка плавлення речовини знижується. Відсутність зниження температури плавлення суміші речовини, що досліджують, з стандартною речовиною розглядається як доказ їх ідентичності (або їх повної взаємної нерозчинності).
Між температурою плавлення речовини та її молекулярною будовою є певна залежність.
В гомологічних рядах аліфатичних сполук CnH2n+2 із збільшенням молекулярної маси речовини температура плавлення підвищується, а різниця між сусідніми членами ряду поступово зменшується (рис. 2.1.).

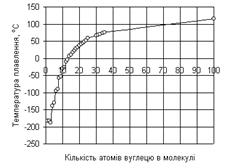
Можна відзначити, що речовини з симетричними молекулами плавляться при більш високій температурі, ніж речовини менш симетричної будови. Так, наприклад, парафіни нормальної (нерозгалуженої) будови мають більш високу температуру плавлення, ніж парафіни ізомерної будови з тим же числом атомів вуглецю.
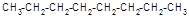
| 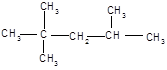
|
| н-октан, tпл = -56, 8оС | 2, 2, 4-триметилпентан, tпл = -107, 38оС (ізооктан) |
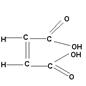
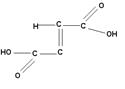
У стерео ізомерних сполук транс-ізомер, як правило, плавиться при більш високій температурі:
| 
|
| Малеїнова кислота, tпл= 130оС | Фумарова кислота, tпл= 287оС |
Температура плавлення речовини зростає із збільшенням степені асоціації молекул. Так, складні ефіри, що не здатні до утворення місткового водневого зв’язку, плавляться при значно більш низьких температурах, ніж відповідні карбонові кислоти (порівняй, наприклад, оцтову кислоту tпл= +16, 6оС та етилацетат, tпл= -82, 4оС).
Таблиця 2.1. Температура плавлення деяких ізомерних дизаміщених похідних бензолу
| Речовина | Температура плавлення ізомерів, оС | ||
| Орто | Мета | Пара | |
| Ксилол | - 28 | -53 | |
| Дихлорбензол | - 18 | - 25 | |
| Діоксибензол | |||
| Діамінобензол | |||
| Динітробензол | |||
| Фторбензойна кислота | |||
| Хлорбензойна кислота | |||
| Бромбензойна кислота | |||
| Нітробензойна кислота |
Таблиця 2.2. Температура плавлення деяких три заміщених похідних бензолу
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
| Речовина | Температура плавлення ізомерів, оС | ||
| 1, 2, 3 - | 1, 2, 4 - | 1, 3, 5 - | |
| Трихлорбензол | |||
| Трибромбензол | |||
| Трийодбензол | |||
| Триоксибензол |
Заміщення атома водню на атом галоїду, гідроксильну, карбоксильну або аміногрупу призводить до підвищення температури плавлення. При заміщенні атомом галоїду температура плавлення підвищується відповідно з підвищенням атомної маси галоїду: йод замісні похідні плавляться при температурах вищих, ніж бром- та хлорзаміщені.
В ароматичному ряду із дизаміщених похідних бензолу найбільш високу температуру плавлення мають п- ізомери (див. табл. 2.1.1), а серед тризаміщених при більш високій температурі плавляться 1, 3, 5-похідні (див. табл.2.2).
Обладнання та матеріали: термометр, капіляр, годинникове скло, скляна трубка, прилад для вимірювання температури, гумове кільце, колбонагрівач або електроплитка.
Реактиви: бензойна кислота С6Н5СООН - 0.5 г (або інша тверда речовина).

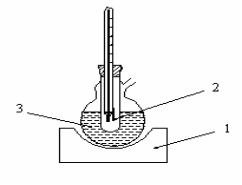 Виконання експерименту. Для економії часу спочатку визначають приблизну температуру плавлення. Кілька дрібних кристалів речовини поміщають на кульку термометра в горизонтальному положенні. Термометр нагрівають на закритій електроплитці. У момент початку плавлення кристалів відзначають показання термометра. Точну температуру плавлення твердої речовини можна визначати при нагріванні на колбонагрівачі (1) сірчаної кислоти (3) в приладі, зображеному на рис. 2.2. Запаяний з одного кінця капіляр (2), у який поміщають речовину, має внутрішній діаметр 0, 8-1, 0 мм і довжину 35-45 мм. Капіляр наповняють речовиною так, щоб щільний шар його займав 3-4 мм. Для утворення щільного шару речовини капіляр кидають запаяним кінцем униз через скляну трубку діаметром 10 мм і висотою 60-80 см, що стоїть вертикально на годинному склі. Капіляр (2) за допомогою гумового кільця прикріплюють до термометра і поміщають у прилад.
Виконання експерименту. Для економії часу спочатку визначають приблизну температуру плавлення. Кілька дрібних кристалів речовини поміщають на кульку термометра в горизонтальному положенні. Термометр нагрівають на закритій електроплитці. У момент початку плавлення кристалів відзначають показання термометра. Точну температуру плавлення твердої речовини можна визначати при нагріванні на колбонагрівачі (1) сірчаної кислоти (3) в приладі, зображеному на рис. 2.2. Запаяний з одного кінця капіляр (2), у який поміщають речовину, має внутрішній діаметр 0, 8-1, 0 мм і довжину 35-45 мм. Капіляр наповняють речовиною так, щоб щільний шар його займав 3-4 мм. Для утворення щільного шару речовини капіляр кидають запаяним кінцем униз через скляну трубку діаметром 10 мм і висотою 60-80 см, що стоїть вертикально на годинному склі. Капіляр (2) за допомогою гумового кільця прикріплюють до термометра і поміщають у прилад.
При визначенні температури плавлення нагрівання ведуть спочатку зі швидкістю 4-6 град/хв., а ближче до температури плавлення - від 1 до 2 град/хв. Варто фіксувати температурний інтервал від появи рідкої фази до повного розплавлювання речовини в капілярі. Ознакою чистоти речовини є чітка температура плавлення (інтервал не перевищує 0, 5 град). Практично вважається припустимим, коли речовина плавиться в межах 1-2 град.
Найбільш точні результати, що характеризують чистоту речовини та температуру його плавлення, можна одержати при вивченні так званих кривих кристалізації або кривих плавлення. Такі криві є графічним зображенням процесу кристалізації або плавлення і показують зміну температури речовини з часом при постійній швидкості втрати або одержання тепла.
При кристалізації розплавленої речовини крива має певну форму, що пов’язано з виділенням скритої теплоти кристалізації. Спочатку, внаслідок деякого переохолодження, температура падає нижче температури кристалізації, потім піднімається і, поки йде процес кристалізації, зберігає майже постійну величину, що передається відповідною сходинкою або площадкою (рис. 2.3.).
Чим чистіше речовина, тим менше кут нахилу площадки до горизонталі. Тому, якщо речовина чиста, то це зразу видно з характеру кривої, і відпадає необхідність в повторному очищенні для підтвердження незмінності температури плавлення.
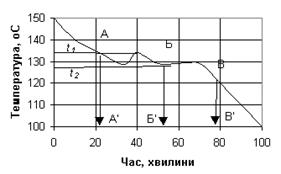 В ряді випадків аналіз кривої дозволяє чітко встановити особливості процесу кристалізації таких речовин, які мають подвійні та потрійні температури плавлення, тобто утворюють різні кристалічні форми.
В ряді випадків аналіз кривої дозволяє чітко встановити особливості процесу кристалізації таких речовин, які мають подвійні та потрійні температури плавлення, тобто утворюють різні кристалічні форми.
 Недолік визначення температури плавлення шляхом аналізу кривих кристалізації або кривих плавлення є в тому, що для цього методу потрібно значно більшу кількість речовини, ніж при визначенні в капілярах.
Недолік визначення температури плавлення шляхом аналізу кривих кристалізації або кривих плавлення є в тому, що для цього методу потрібно значно більшу кількість речовини, ніж при визначенні в капілярах.
2.2. Температура кипіння та її визначення
Принцип методу: Температура кипіння, тобто та температура, при якій тиск насиченої пари рідини дорівнює зовнішньому тиску, залежить від молекулярної маси і будови рідкої речовини, від сил притягання молекул рідини між собою та від складу рідини, якщо вона не є чистою речовиною.
Температура кипіння речовини на відміну від температури плавлення дуже сильно залежить від тиску. Залежність тиску пари від температури виражається рівнянням Клаузіуса-Клайперона:
d ln p/dT = L v /RT,
де p – тиск пари; L v – молярна теплота випаровування; Т – температура, К; R - газова стала.
Визначаючи температуру кипіння, необхідно знати тиск, при якому вона визначалася.. Вплив забруднень на температуру кипіння в великій степені залежить від характеру домішок. Легко леткі речовини знижують температуру кипіння, а домішка з такою ж температурою кипіння, як і основна речовина, не змінить його температуру кипіння. Незначні забруднення значно менше впливають на температуру кипіння, ніж на температуру плавлення. Отже, температура кипіння не має такого значення для визначення критерію чистоти речовини, як у випадку температури плавлення. Температура кипіння в більшій степені залежить від будови речовини, ніж температура плавлення. В гомологічних рядах як аліфатичних, так і ароматичних сполук при введенні в молекулу однієї групи -СН2- температура кипіння підвищується приблизно на 19-21оС.
Заміщення атому водню в молекулі вуглеводню призводить до таких змін температури кипіння:
| Замісник | F | Cl | Br | I | OH |
| Підвищення температури, оС | 20-60 | ~60 | 80-85 | 105 - 115 |
Ізомерні сполуки також киплять, як правило, при різній температурі. В аліфатичному ряду нормальні сполуки мають найбільш високу температуру кипіння, і чим більше розгалужений ланцюг вуглецевих атомів, тим нижче температура кипіння речовини. В ароматичному ряду при більш високій температурі киплять орто - ізомери.
Приблизну температуру кипіння сполуки можна обчислити за таким емпіричним рівнянням:
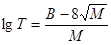
де T - абсолютна температура кипіння, К; М - молекулярна маса; В - сума емпірично встановлених атомних та групових інкрементів (див. таблицю 2.3)
Таблиця 2.3. Атомні та групові інкременти для обчислення температури кипіння
| Атом | Інкремент | Атом або група атомів | Інкремент |
| Водень | 10, 9 | Сірка (SVI) | 76, 0 |
| Вуглець | 23, 2 | Сірка (SVI) | 105, 3 |
| Азот | 39, 7 | Арсен (AsIII) | 222, 0 |
| Кисень | 51, 0 | Подвійний зв’язок | 16, 1 |
| Фтор | 68, 0 | Потрійний зв’язок | 33, 0 |
| Хлор | 121, 0 | 3-членний цикл | 16, 0 |
| Бром | 255, 0 | 4-, 5- або 6-членний цикл | 17, 7 |
| Йод | 398, 0 | 7-, 8- або 9-членний цикл | 18, 5 |
Найбільш точні результати обчислення температури кипіння одержують для таких сполук, молекули яких мало асоційовані. Температура кипіння сильно асоційованих сполук, наприклад, кислот, спиртів тощо, дають значні відхилення від обчислених величин і їх не можна знаходити за цим способом.
Приклад визначення температури кипіння бензолу за емпіричною формулою:
C6H6 М=78
В = 6(С) + 6(Н) + 3(Подвійний зв’язок) + 1(6-членний цикл)= 6´ 10, 9 + 6´ 23, 2 + 3´ 16, 1 + 1´ 17, 7=270, 6
lgT = (270, 6 - 8Ö 78)/78 = 2, 56; Т= 363, 1 К або t=90оС. В дійсності температура кипіння бензолу 80, 1оС при тиску 760 мм рт. ст.
Завдання: визначити температуру кипіння толуолу та бутилового спирту за формулою та порівняти одержані значення з табличними даними, пояснити різницю між розрахованими та табличними значеннями. Температуру кипіння можна визначати як в паровій, так і в рідкій фазі. Визначення температури кипіння в парі дає більш точні результаті тому, що температура пари практично не залежить від деяких коливань температури усередині рідини, які можуть виникати при її нагріванні.
Обладнання та матеріали: термометр, 2 капіляри (різні за діаметром), годинникове скло, прилад для вимірювання температури, резинове кільце, колбонагрівач або електроплитка. Реактиви: бензол, толуол, бутиловий або ізоаміловий спирт тощо.
 Визначення температури кипіння. Температуру кипіння визначають у спеціальному приладі ебуліоскопі. Принцип його дії заснований на тому, що рідину нагрівають до кипіння в приладі із зворотнім холодильником і відмічають температуру. При визначенні температури кипіння в процесі перегонки особливу увагу треба звертати на положення кульки термометра. Вона повинна знаходитися на 1 см нижче відвідної трубки насадки.
Визначення температури кипіння. Температуру кипіння визначають у спеціальному приладі ебуліоскопі. Принцип його дії заснований на тому, що рідину нагрівають до кипіння в приладі із зворотнім холодильником і відмічають температуру. При визначенні температури кипіння в процесі перегонки особливу увагу треба звертати на положення кульки термометра. Вона повинна знаходитися на 1 см нижче відвідної трубки насадки.
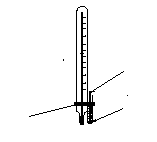
Також може бути рекомендований метод Сиволобова (рис. 2.4).
 У широкий капіляр (3) довжиною 2, 5-3 см і діаметром 3 мм поміщають декілька крапель перегнаної рідини. У цей же капіляр опускають інший, більш тонкий капіляр (довжина 30-35 мм), запаяний з верхнього кінця (2). Капіляри закріплюють на термометрі гумовим кільцем (3) і вносять у прилад аналогічно тому, як це робиться при визначенні температури плавлення. При повільному нагріванні приладу з внутрішнього капіляра починають повільно виділятися пухирці повітря. Швидке виділення пухирців указує, що рідина закипіла. Тоді нагрівання припиняють і відмічають температуру, при якій виділення пухирців різко припиняється. Це і є температура кипіння.
У широкий капіляр (3) довжиною 2, 5-3 см і діаметром 3 мм поміщають декілька крапель перегнаної рідини. У цей же капіляр опускають інший, більш тонкий капіляр (довжина 30-35 мм), запаяний з верхнього кінця (2). Капіляри закріплюють на термометрі гумовим кільцем (3) і вносять у прилад аналогічно тому, як це робиться при визначенні температури плавлення. При повільному нагріванні приладу з внутрішнього капіляра починають повільно виділятися пухирці повітря. Швидке виділення пухирців указує, що рідина закипіла. Тоді нагрівання припиняють і відмічають температуру, при якій виділення пухирців різко припиняється. Це і є температура кипіння.
2.3. Рефрактометрія. Визначення показника заломлення
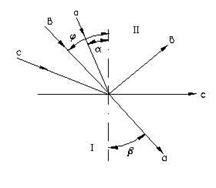
 Промінь світла, проходячи з одного прозорого середовища (повітря) в друге (рідину), падаючи з нахилом до поверхні розділу фаз, змінює свій початковий напрямок, тобто заломлюється. Кут a, що утворюється напрямком падаючого променя і нормаллю (рис.2.5) називається кутом падіння, а кут b, що утворюється напрямком заломленого променя цієї нормалі, - кутом заломлення. Співвідношення синуса кута падіння a до синуса кута заломлення b є постійною величиною для заданих двох середовищ і називається показником заломлення середовища ІІ по відношенню до середовища І (середовищем І за звичай є повітря):
Промінь світла, проходячи з одного прозорого середовища (повітря) в друге (рідину), падаючи з нахилом до поверхні розділу фаз, змінює свій початковий напрямок, тобто заломлюється. Кут a, що утворюється напрямком падаючого променя і нормаллю (рис.2.5) називається кутом падіння, а кут b, що утворюється напрямком заломленого променя цієї нормалі, - кутом заломлення. Співвідношення синуса кута падіння a до синуса кута заломлення b є постійною величиною для заданих двох середовищ і називається показником заломлення середовища ІІ по відношенню до середовища І (середовищем І за звичай є повітря):
n = sin a /sin b
Показником заломлення n називають співвідношення швидкості розповсюдження світла в повітрі до швидкості розповсюдження світла в досліджуваній речовині (розчині). Він є однією з важливих фізичних констант, що характеризують дану речовину, і залежить від довжини хвилі падаючого світла, температури, тиску та концентрації (якщо це є розчин).
З порівняно великої кількості методів найбільше розповсюдження одержав метод визначення показника заломлення за граничним кутом заломлення або повного внутрішнього відбиття. Коли промінь світла падає із середовища з показником заломлення n1 середовище з показником заломлення n2, то між кутом падіння a та кутом заломлення b існує залежність:
n1sinb = n2sina
При деякому куті падіння кут заломлення може стати рівним 90о (sin b = 1); в цьому випадку заломлений промінь буде ковзати по поверхні розподілу середовищ. Кут падіння променя, при якому спостерігається це явище, називається кутом повного внутрішнього відбиття. Знаючи цей кут, можна визначити показник заломлення даної речовини
Нехай промінь світла падає на межу розділу двох середовищ I і II (рис.21); нехай середовище I має більшу оптичну густину, ніж II. В цьому випадку кут падіння менше кута заломлення. Якщо кут падіння наближується до свого граничного значення 90о, то кут заломлення може стати рівним 90о. В такому випадку промінь світла не входить в друге середовище, а ковзає по поверхні розподілу фаз. При подальшому збільшенні кута падіння промінь відбивається від середовища II. Це явище називається повним внутрішнім відбиттям, а кут падіння, при якому воно наступає – граничним кутом падіння φ. В цьому випадку рівняння
n1sin90о = n2sinφ
Оскільки sin90о = 1, тоn1 = n2sinφ. Якщо показник заломлення одного середовища n2 є відомим, то достатньо виміряти граничний кут φ, щоб визначити показник заломлення середовища, яке аналізуємо.
Показник заломлення залежить від довжини хвилі випромінювання. Промені різної довжини заломлюються різним чином. Залежність показника заломлення світла у речовині від довжині хвилі світла називають дисперсією світла або рефракційною дисперсією.
Вплив температури на показник заломлення визначається двома факторами: зміною числа частинок речовини в одиниці об’єму і залежністю здатності до поляризації від температури.
Для більшої частини рідин показник заломлення зменшується приблизно на 0, 00015 при збільшенні температури на 1оС. Тому для того, щоб можна було робити виміри з точністю до четвертого знака, температуру рідких зразків необхідно підтримувати з точністю до ±0, 2оС. Показнику заломлення придають два індекси: верхній, що позначає температуру, і нижній – довжину виді. Наприклад, nD 20 означає, що виміри виконано при 20оС і при довжині хвилі жовтої лінії D спектра натрію (589, 3 нм).
Рефрактометричний метод широко застосовується для ідентифікації і визначення чистоти багатьох органічних речовин, а також для кількісного аналізу розчинів. Для проведення кількісних визначень за показником заломлення попередньо будують калібровочний графік Для цього готують серію розчинів з відомими концентраціями, вимірюють їх показники заломлення і будують калібровочний графік в координатах концентрація – показник заломлення.
Для рідких органічних речовин показник заломлення змінюється в межах від 1, 3 до 1, 7. Найчастіше показник заломлення вимірюють при довжині хвилі, що відповідає довжині хвилі жовтої лінії натрію D при температурі 200 (позначають n20).
Рефрактометр РЛ і робота на ньому. Рефрактометр лабораторний є найбільш простим за будовою і у користуванні. (рис. 2.6). До штатива рефрактометра на зігнутій ручці прикріплено увігнуте дзеркало 8, за допомогою якого промінь світла направляється на віконце призми. Для перевірки нульової точки приладу (за дистильованою водою наносять піпеткою 1-2 краплі води на поліровану поверхню вимірювальної (нижньої) призми (2), опускають та закріплюють гвинтом верхню призму, потім встановлюють окуляр приладу на різкість (всовуючи та висовуючи його) за очима спостерігача. Якщо нульова точка зміщена (показник заломлення води дорівнює 1, 3330 при 20оС), то через люк 7 ключем підгвинчують регулюючий гвинт так, щоб шкала показала точно значення 1, 3330.

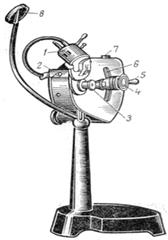 Нижню призму (2) ретельно протирають фільтрувальним папером і на неї наносять 1-2 краплі рідини, що досліджують, опускають верхню призму і проводять відлік показника заломлення. Через окуляр 4 видно ділянку шкали 6. На шкалі 6 нанесені значення показника заломлення в інтервалі від 1, 3000 до 1, 540. Окуляр направляють так, щоб видима межа розділу між світлою та темною частинами поля зору співпала з трьома мітками, що нанесені по діаметру окуляра. Якщо межова лінія розмита і забарвлена в різні радужні кольори, відлік за шкалою приладу робити не можна. За допомогою ручки гвинта-компенсатора 3 домагаються чіткої межі поділу між світлою і темною частиною поля зору.
Нижню призму (2) ретельно протирають фільтрувальним папером і на неї наносять 1-2 краплі рідини, що досліджують, опускають верхню призму і проводять відлік показника заломлення. Через окуляр 4 видно ділянку шкали 6. На шкалі 6 нанесені значення показника заломлення в інтервалі від 1, 3000 до 1, 540. Окуляр направляють так, щоб видима межа розділу між світлою та темною частинами поля зору співпала з трьома мітками, що нанесені по діаметру окуляра. Якщо межова лінія розмита і забарвлена в різні радужні кольори, відлік за шкалою приладу робити не можна. За допомогою ручки гвинта-компенсатора 3 домагаються чіткої межі поділу між світлою і темною частиною поля зору.
Після вимірювань призми промивають дистильованою водою і ретельно протерають фільтрувальним папером або фланеллю, не допускаючи подряпин на поверхні призм.
Перевірка приладу й установка на нуль. Перед початком роботи на приладі перевіряється нульова точка за допомогою дистильованої води, для чого 1-2 краплі води наносять на поліровану поверхню вимірювальної призми. Візирну лінію лупи шкали встановлюють на поділку 1, 333 і в зорову трубу спостерігають положення межі світлотіні відносно точки перетину двох взаємно перпендикулярних ліній (при встановленні на різкість в окулярі зорової труби може спостерігатися забарвлення межі світлотіні – її усувають обертанням рукоятки дисперсійного компенсатора). Якщо границя світлотіні проходить через точку перетину візирних ліній, то прилад установлено на нуль. Якщо цього немає, то за допомогою юстировочного ключа встановлюють границю світлотіні на точку перетину візирних ліній (рис. 2.7).
 Робота з приладом. Після перевірки нульової точки піднімають верхню частину камери і витирають площини призм спочатку фільтрувальним папером, а потім не ворсистою серветкою. Обережно вносять 1-2 краплі досліджуваного розчину і швидко закривають камеру. Дзеркалом направляють світло у вікно камери і повертають її доти, поки межа світлотіні не з'явиться в полі зору. По шкалі, за допомогою лупи роблять відлік величини показника заломлення розчину. Показник заломлення вимірюється з точністю до четвертого знака після коми (четвертий знак визначається візуально інтерполяцією в межах однієї поділки). Після кожного визначення проби необхідно ретельно промити дистильованою водою площини зіткнення обох частин камери, а потім протерти їх до суха фільтрувальним папером. Визначення показника заломлення проводиться для ідентифікації речовин, для встановлення їхньої чистоти, для визначення концентрації розчинів. Значення показника заломлення використовують для визначення величини молекулярної рефракції.
Робота з приладом. Після перевірки нульової точки піднімають верхню частину камери і витирають площини призм спочатку фільтрувальним папером, а потім не ворсистою серветкою. Обережно вносять 1-2 краплі досліджуваного розчину і швидко закривають камеру. Дзеркалом направляють світло у вікно камери і повертають її доти, поки межа світлотіні не з'явиться в полі зору. По шкалі, за допомогою лупи роблять відлік величини показника заломлення розчину. Показник заломлення вимірюється з точністю до четвертого знака після коми (четвертий знак визначається візуально інтерполяцією в межах однієї поділки). Після кожного визначення проби необхідно ретельно промити дистильованою водою площини зіткнення обох частин камери, а потім протерти їх до суха фільтрувальним папером. Визначення показника заломлення проводиться для ідентифікації речовин, для встановлення їхньої чистоти, для визначення концентрації розчинів. Значення показника заломлення використовують для визначення величини молекулярної рефракції.
Обладнання та матеріали: універсальний лабораторний рефрактометр марки РЛУ, фільтрувальний папір, не ворсиста серветка.
Реактиви: бензол, толуол, бутиловий або ізоаміловий спирт тощо
Завдання: визначити показник заломлення речовин та порівняти їх з довідниковими даними.
|
|
