
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Задачи и упражнения для самостоятельного решения. 22.1. Закончить уравнения реакций: а) Fe + H2SO4 (разб.) = ;
|
|
22.1. Закончить уравнения реакций: а) Fe + H2SO4 (разб.) = …;
б) Fe + HNO3 (оч. разб.) = …; в) Ni + H2SO4 (конц.) = …; г) Co + HCl = ….
22 .2. Написать в молекулярном и ионном виде уравнения реакций взаимодействия гидроксидов железа (II), кобальта (II) и никеля (III) с соляной кислотой.
22.3. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeSO4 → Fe(OH)2 → Fe(OH)3 → FeCl3.
22.4. Могут ли в растворе находиться совместно следующие вещества:
а) FeCl3 и SnCl2; б) FeSO4 и NaOH;
в) FeCl3 и K3[Fe(CN)6; г) FeSO4 и K3[Fe(CN)6?
Для взаимодействующих веществ составить уравнения реакций.
22.5. Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 + CO = 3FeO + CO2.
Вычислить Δ G° х.р. и сделать вывод о возможности самопроизвольного протекания этой реакции при 298 К. В каком направлении сместится равновесие этой реакции при повышении температуры?
(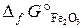 = –1014, 2 кДж/моль;
= –1014, 2 кДж/моль; 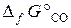 = –137, 1 кДж/моль,
= –137, 1 кДж/моль,
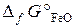 = –244, 3 кДж/моль,
= –244, 3 кДж/моль, 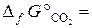 –394, 4 кДж/моль).
–394, 4 кДж/моль).
(Ответ: 24 кДж).
22.6. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Fe → FeСl2 → Fe(CN)2 → K4[Fe(CN)6] → K3[Fe(CN)6].
22.7. Закончить уравнения реакций: а) Fe(OH)2 + O2 + H2O = …;
б) Fe(OH)3 + HCl = …; в) Co(OH)3 + HCl = …; г) Ni(OH)3 + HCl = ….
22.8. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Ni → Ni(NO3)2 → Ni(OH)2 → Ni(OH)3 → NiCl2.
22.9. Какие степени окисления проявляет железо в своих соединениях? Как можно обнаружить ионы Fe2+ и Fe3+ в растворе? Составить молекулярные и ионные уравнения соответствующих реакций.
22.10. Написать в молекулярном и ионном виде уравнения реакций гидролиза солей: а) FeCl2 + H2O ↔ …; б) NiSO4 + H2O ↔ …;
в) Co(NO3)2 + H2O ↔ …; г) Fe2(SO4)3 + H2O ↔ ….
22.11. Закончить уравнения реакций получения ферратов калия и бария (K2FeO4, BaFeO4): а) KOH + FeCl3 + Br2 = K2FeO4 + …;
б) K2FeO4 + BaCl2 = …; в) Fe2O3 + KNO3 + KOH = KNO2 + ….
22.12. Закончить уравнения реакций образования комплексных соединений и назвать их, учитывая, что координационное число железа равно 6, а кобальта и никеля 4. а) Fe(CN)2 + KCN = …;
б) Co(SCN)2 + NH4SCN (избыток) = …; в) NiSO4 + NH4OH (избыток) = ….
22.13. Сколько часов надо вести электролиз раствора FeSO4, чтобы при силе тока в 2 А выделилось 279, 2 г чистого железа? (Ответ: 133, 6 ч).
22.14. Рассчитать молярную массу эквивалентов и эквивалент восстановителя в реакции Fe(OH)2 + KMnO4 + H2O = ….
22.15. Определить тепловой эффект реакции 4FeS2 + 11O2 = 2Fe2O3 + 8SO2,
если в реакции участвует 59, 2 г FeS2, а энтальпии образования реагирующих веществ равны: 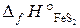 = –148, 5 кДж/моль;
= –148, 5 кДж/моль; 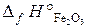 = –803, 3 кДж/моль;
= –803, 3 кДж/моль;
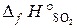 = –297, 4 кДж/моль. (Ответ: –418, 3 кДж).
= –297, 4 кДж/моль. (Ответ: –418, 3 кДж).
22.16. Состав комплексной соли кобальта выражается эмпирической формулой CoCl3∙ 4NH3. При взаимодействии с нитратом серебра осаждается лишь одна треть содержащегося в соли хлора. Учитывая, что координационное число кобальта в этом соединении 6, определить, какие лиганды входят в состав комплексного иона и написать координационную формулу соли.
22.17. По стандартным энтальпиям образования веществ вычислить тепловой эффект реакции, протекающей при выплавке чугуна,
3Fe2O3 + CO = 2Fe3O4 + CO2.
(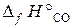 = –110, 5 кДж/моль;
= –110, 5 кДж/моль; 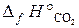 = –393, 5 кДж/моль;
= –393, 5 кДж/моль;
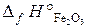 = –822, 2 кДж/моль;
= –822, 2 кДж/моль; 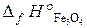 = –1117, 1 кДж/моль).
= –1117, 1 кДж/моль).
(Ответ: –50, 6 кДж).
22.18. Закончить в молекулярном и ионном виде уравнения качественных реакций на ион Fe3+: а) Fe2(SO4)3 + KOH = …; б) FeCl3 + K4[Fe(CN)6] = …;
в) Fe(NO3)3 + KSCN = ….
22.19. Закончить уравнения реакций: а) FeSO4 + Br2 + H2SO4 = …;
б) FeCl3 + H2S = …; в) FeCl3 + Na2CO3 + H2O = …; г) Fe + HNO3 (разб.) = ….
22.20. Как влияет на коррозию железа его контакт с другими металлами? Какой металл будет разрушаться первым при повреждении поверхности а) луженого, б) оцинкованного; в) никелированного железа? Составить схемы образующихся гальванических элементов. Написать уравнения реакций катодных и анодных процессов.
|
|
