
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи и упражнения для самостоятельного решения. 18.1. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
|
|
18.1. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
Al → Al2(SO4)3 → Al(OH)3 → К[Al(OH)4] → Al(NO3)3.
18.2. Чем можно объяснить восстановительные свойства соединений олова (II) и окислительные свойства соединений свинца (IV)? Закончить уравнения реакций: а) SnCl2 + HgCl2 = …;
б) KCrO2 + PbO2 + KOH = K2CrO4 + ….
18.3. Какие оксиды и гидроксиды образует олово? Как изменяются их кислотно-основные свойства в зависимости от степени окисления Sn? Закончить уравнения реакций: а) SnO2 + KOH = …; б) SnO + H2SO4 = …; в) Sn(OH)2 + NaOH = ….
18.4. При сжигании 18 г алюминия в кислороде выделилось 558 кДж теплоты. Определить энтальпию образования Al2O3. (Ответ: − 1674 кДж/моль).
18.5. Закончить уравнения окислительно-восстановительных реакций:
а) PbO2 + Cr(NO3)3 + NaOH = Na2CrO4 + …; б) SnCl2 + FeCl3 = ….
18.6. Написать уравнения реакций взаимодействия металлов с кислотами:
а) Sn + H2SO4 (разб.) = …; б) Pb + HNO3 (конц.) = …; в) Sn + HNO3 (конц.) = ….
18.7. Закончить в молекулярном и ионном виде уравнения реакций гидролиза солей: а) AlCl3 + H2O ↔ …; б) SnSO4 + H2O ↔ …; в) Pb(NO3)2 + H2O ↔ ….
18.8. Какие оксиды и гидроксиды образует свинец? Как изменяются их кислотно-основные и окислительно-восстановительные свойства в зависимости от степени окисления свинца? Закончить уравнения реакций:
а) PbO2 + NaOH = …; б) PbO + HNO3 = …; в) Pb(OH)2 + KOH = ….
18.9. Рассчитать Δ G° х.р.и установить возможность самопроизвольного протекания реакции 4Al + 3CO2 =2Al2O3 + 3C. (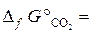 –394, 4 кДж/моль;
–394, 4 кДж/моль; 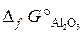 = –1582 кДж/моль).
= –1582 кДж/моль).
18.10. Закончить уравнения реакций: а) Al + HCl = …;
б) Sn + HNO3 (разб.) = …; в) Pb + HNO3 (разб.) = …; г) Al + KOH + H2O = ….
18.11. Вычислить Δ H° х.р.реакции восстановления оксида свинца углем с образованием СО. (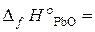 –219, 3 кДж/моль;
–219, 3 кДж/моль; 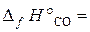 –110, 5 кДж/моль).
–110, 5 кДж/моль).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
(Ответ: 108, 8 кДж).
18.12. Как можно получить α -оловянную кислоту, а затем перевести ее в раствор? Написать соответствующие уравнения реакций.
18.13. При электролизе водного раствора SnCl2 на аноде выделилось 4, 48 л хлора (условия нормальные). Найти массу выделившегося на катоде олова.
(Ответ: 23, 7 г)
18.14. Каким образом можно перевести в раствор металлический свинец? Составить соответствующие уравнения реакций.
18.15. Составить схемы электролиза водного раствора Pb(NO3)2, если: а) анод свинцовый; б) анод угольный.
18.16. Как можно перевести в раствор металлическое олово? Составить соответствующие уравнения реакций.
18.17. К раствору, содержащему SnSO4 и Pb(NO3)2, прибавили избыток раствора КОН. Составить молекулярные и ионные уравнения происходящих при этом реакций.
18.18. Как можно перевести в раствор металлический алюминий? Составить соответствующие уравнения реакций.
18.19. Закончить уравнения реакций:
а) SnCl2 + KMnO4 + H2SO4 = Sn(SO4)2 + …;
б) PbO2 + Na3CrO3 + NaOH = ….
18.20. Закончить уравнения реакций:
а) Al + KMnO4 + H2SO4 = …;
б) AlCl3 + Na2CO3 + H2O = ….
|
|
