
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задачи и упражнения для самостоятельного решения. 16.1. Написать уравнения реакций взаимодействия натрия с водородом, кислородом, азотом, серой
|
|
16.1. Написать уравнения реакций взаимодействия натрия с водородом, кислородом, азотом, серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
16.2. Написать уравнения реакций взаимодействия с водой следующих соединений натрия: Na2O2, Na2S, NaH, Na3N.
16.3. Как получают металлический натрий? Составить уравнения процессов, происходящих на электродах при электролизе расплава NaCl.
16.4. Составить уравнения реакций получения гидрида, нитрида и карбида кальция и взаимодействия этих соединений с водой.
16.5. Закончить уравнения реакций: а) Li2O + CO2 = …;
б) Na2O2 + Na2SO3 + H2O = …; в) K2S + H2O ↔ …; г) NaCl + K[Sb(OH)6] = ….
16.6. Составить уравнения реакций, которые нужно провести для осуществления следующих превращений:
Са → СаН2 → Са(ОН)2 → СаСО3 → Са(НСО3)2.
16.7. Гидроксид какого из s -металлов проявляет амфотерные свойства? Составить молекулярные и ионные уравнения реакций взаимодействия этого гидроксида: а) с кислотой; б) со щелочью.
16.8. Составить уравнения реакций взаимодействия: а) бериллия с раствором щелочи; б) кальция с соляной кислотой; в) магния с концентрированной серной кислотой.
16.9. При сплавлении оксид бериллия взаимодействует с диоксидом кремния и с оксидом натрия. Написать уравнения соответствующих реакций. О каких свойствах ВеО свидетельствуют эти реакции?
16.10. Какая масса КОН образовалась у катода при электролизе раствора К2SO4, если на аноде выделилось 11, 2 л О2 (условия нормальные)? (Ответ: 112 г).
16.11. Вычислить молярную концентрацию водного раствора КОН, полученного при растворении 1, 5 г щелочи в 48, 5 воды. Плотность раствора 1, 027 г/мл.
(Ответ: 0, 52 моль/л).
16.12. Вычислить энтальпию образования MgO, исходя из уравнения реакции MgO + C = Mg + CO, Δ H° = 491, 3 кДж. (Δ fH° CO = –110, 5 кДж/моль).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
(Ответ: –601, 8 кДж).
16.13. Вычислить количество теплоты, которое выделится при взаимодействии 8 г гидрида натрия с водой. Стандартные энтальпии образования NaH, NaOH, H2O (ж) принять соответственно равными –56, 4; –425, 6 и –285, 8 кДж/моль. (Ответ: 27, 8 кДж).
16.14. Каким объемом 35 %-го раствора КОН (ρ = 1, 34 г/мл) можно заменить 10 л 4 н. раствора КОН? (Ответ: 4, 78 л).
16.15. Закончить уравнения реакций: а) Na2O2 + KNО2 + H2SO4 = …;
б) L3N + H2O = …; в) K + O2 = …; г) CaCO3 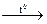 ….
….
16.16. Написать уравнения реакций взаимодействия лития с водородом, кислородом, азотом, серой. Какую степень окисления приобретают атомы окислителя в каждой из этих реакций?
16.17. При электролизе водного раствора NaOH на аноде выделилось 2, 8 л О2 (нормальные условия). Какой объем Н2 выделится на катоде? (Ответ: 5, 6 л).
16.18. Вычислить Δ G° реакции горения магния в диоксиде углерода. Энергии Гиббса образования MgO, СО2, СО принять соответственно равными –569, 6;
–394, 4; –137, 1 кДж/моль. Возможно ли самопроизвольное протекание этой реакции? (Ответ: –312, 6 кДж).
16.19. Можно ли получить кальций восстановлением его оксида алюминием? Ответ обосновать расчетом энергии Гиббса реакции. Энергии Гиббса образования СаO и Al2O3 принять соответственно равными –604, 2 и –1582 кДж/моль.
16.20. Закончить уравнения реакций: а) Be + KOH + H2O = …;
б) Li2C2 + H2O = …; в) Mg + H2O = …; г) Na2SO3 + H2O ↔ ….
|
|
