
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Для второго электрода
|
|
j Ag+/Ag = j ° Ag+/Ag + 0, 059 lg 10-4 = 0, 799 + 0, 059× (–4) = 0, 563 В.
Первый электрод с большим значением потенциала в данном элементе является катодом, второй – анодом. ЭДС рассчитываем по формуле
E = j к – j а = 0, 74 – 0, 563 = 0, 177 В.
Пример 12.2. Рассчитать ЭДС элемента Cd½ Cd2+ || Ni2+½ Ni при концентрации ионов Cd2+ и Ni2+, равных соответственно 0, 1 и 0, 001 моль/л.
Решение. Используя уравнения Нернста и данные таблицы стандартных электродных потенциалов, рассчитываем электродные потенциалы Cd и Ni:
j Сd2+/Cd = j ° Сd2+/Cd + 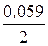 lg 10-3 = –0, 403 + 0, 0295× (–3) = –0, 4915 В;
lg 10-3 = –0, 403 + 0, 0295× (–3) = –0, 4915 В;
j Ni2+/Ni = j ° Ni2+/Ni + 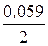 lg 10-1 = –0, 250 + 0, 0295× (–1) = –0, 2795 В.
lg 10-1 = –0, 250 + 0, 0295× (–1) = –0, 2795 В.
Так как j Сd2+/Cd < j Ni2+/Ni, то токообразующей в этом гальваническом элементе является реакция Cd0 + Ni2+ = Cd2+ + Ni0. Рассчитываем ЭДС элемента
E = j Ni2+/Ni – j Сd2+/Cd = –0, 2795 – (–0, 4915) = 0, 212 В.
Пример 12.3. Исходя из значений стандартных электродных потенциалов и D G °х.р., указать, можно ли в гальваническом элементе осуществить реакцию Pb2+ + Ti = Pb + Ti2+. Составить схему гальванического элемента, написать уравнения электродных реакций.
Решение. В соответствии с уравнением реакции схему гальванического элемента можно представить следующим образом:
(–) Ti½ Ti2+|| Pb2+½ Pb (+).
Уравнения электродных реакций имеют вид:
на аноде Ti0 – 2ē ® Ti2+
на катоде Pb2++ 2ē ® Pb0
Рассчитываем стандартное значение ЭДС:
E° = j ° к – j ° а = j ° Pb2+/Pb – j ° Ti2+/Ti = –0, 126 – (–1, 628) = 1, 502 B.
Энергию Гиббса рассчитываем по уравнению D G = –nE°F = –2× 1, 502× 96500 = = –289, 9 кДж. Так как D G° < 0, токообразующая реакция возможна.
Пример 12.4. Как изменится масса цинковой пластинки при взаимодействии ее с растворами: а) CuSO4; б) MgSO4; в) Pb(NO3)2? Почему? Составить молекулярные и ионные уравнения соответствующих реакций.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Решение. В соответствии со значениями стандартных электродных потенциалов ионы меди и свинца по отношению к цинку будут проявлять окислительную активность. При контакте с растворами CuSO4 и Pb(NO3)2 будут протекать реакции растворения цинка и осаждения соответствующего металла:
а) CuSO4 + Zn = Cu + ZnSO4, Cu2+ + Zn = Cu + Zn2+;
б) Pb(NO3)2 + Zn = Pb + Zn(NO3)2, Pb2+ + Zn = Pb + Zn2+.
Один моль эквивалентов цинка (32, 69 г/моль) будет замещаться на один моль эквивалентов меди (31, 77 г/моль) или свинца (103, 6 г/моль). Учитывая молярные массы эквивалентов этих элементов, в растворе CuSO4 масса цинковой пластины будет незначительно уменьшаться, а в растворе Pb(NO3)2 – заметно увеличиваться.
Стандартный потенциал магния имеет меньшее значение, чем потенциал цинка. Это означает, что ионы магния не могут окислять цинковую пластинку. Поведение цинка в таком растворе аналогично окислению цинковой пластинки в воде: Zn – 2ē = Zn2+. Протекание такого процесса приведет к малозаметному снижению массы цинковой пластинки.
Пример 12.5. Как происходит коррозия цинка, находящегося в контакте с кадмием, во влажном воздухе и в кислом растворе (НСl)? Составить уравнения анодного и катодного процессов. Привести схемы образующихся при этом гальванических элементов. Определить состав продуктов коррозии.
Решение. Цинк имеет меньшее значение потенциала (–0, 763 В), чем кадмий
(–0, 403 В), поэтому он является анодом, а кадмий – катодом. Следовательно, цинк растворяется, а на поверхности кадмия идет восстановление: в кислом растворе – ионов водорода, во влажном воздухе – растворенного в воде кислорода.
Анодный процесс Zn – 2ē = Zn2+.
Катодный процесс 2Н+ + 2ē ® Н2 (в кислом растворе);
О2 + 2Н2О + 4ē ® 4ОН– (во влажном воздухе).
Схема образующегося гальванического элемента во влажном воздухе:
(–) Zn | O2, H2O½ Cd (+).
Схема образующегося гальванического элемента в кислом растворе:
(–) Zn½ HCl½ Cd (+).
Во влажном воздухе ионы Zn2+ с гидроксильными группами, выделяющимися на катоде, образуют малорастворимый гидроксид цинка Zn(ОН)2, который и является продуктом коррозии.
В кислой среде на поверхности кадмия выделяется газообразный водород. В раствор переходят ионы Zn2+.
Пример 12.6. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии, если эта пара металлов попадает в кислую среду (HCl)? Привести уравнения анодного и катодного процессов, схему образующегося гальванического элемента. Каков состав продуктов коррозии?
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Решение. По положению в ряду напряжений металлов видно, что хром более активный металл (j ° Сr3+/Cr = –0, 744 В), чем медь (j ° Сu2+/Cu = 0, 337 В). В образованной гальванической паре Cr – анод, он окисляется, а Cu – катод, на ее поверхности выделяется (восстанавливается) водород из HCl.
Анодный процесс: Cr –3ē = Cr3+
Катодный процесс в кислой среде: 2Н+ + 2ē ® Н2
Схема гальванического элемента: (–) Cr½ HCl½ Cu (+)
Появляющиеся ионы Cr3+ образуют с хлорид-анионами (из HCl) растворимое соединение – CrC13, на поверхности меди выделяется Н2.
|
|
