
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Примеры решения задач. Пример 8.1.Составить молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
|
|
Пример 8.1. Составить молекулярные уравнения реакций, которым соответствуют следующие ионно-молекулярные уравнения:
Fe(OH)3 + 3H+ = Fe3+ + 3H2O;
H3PO4 + 3OH− = PO43− + 3H2O;
HCO3− + OH− = CO32− + H2O.
Решение. В левой части данных ионно-молекулярных уравнений указаны ионы, которые образуются при диссоциации сильных электролитов, следовательно, при составлении молекулярных уравнений следует исходить из соответствующих растворимых сильных электролитов. Например:
Fe(OH)3 + 3HCl = FeCl3 + 3H2O;
H3PO4 + 3NaOH = Na3PO4 + 3H2O;
KHCO3 + KOH = K2CO3 + H2O.
При выполнении подобных заданий следует пользоваться табл. Б.3.
Пример 8.2. Составить молекулярные и ионно-молекулярные уравнения реакций, подтверждающие амфотерный характер гидроксида свинца.
Решение. Амфотерные электролиты могут диссоциировать по типу кислоты и основания, поэтому Pb(OH)2 может растворяться как в кислоте, проявляя свойство основания, так и в щелочи, проявляя свойства кислоты.
Как основание: Pb(OH)2 + 2HNO3 = Pb(NO3)2 + 2H2O
Pb(OH)2 + 2H+ = Pb2+ + 2H2O.
Как кислота: Pb(OH)2 + 2NaOH = Na2[Pb(OH)4]
Pb(OH)2 + 2OH‾ = [Pb(OH)4]2− .
Схема диссоциации Pb(OH)2:
2H+ + [Pb(OH)4]2− 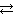 Pb(OH)2 + 2H2O
Pb(OH)2 + 2H2O 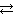 [Pb(H2O)2]2+ +2OH‾ .
[Pb(H2O)2]2+ +2OH‾ .
|
|
