
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Рівняння Ван – дер - Ваальса.
|
|
Для врахування цих відмінностей голландський фізик Я. Ван – дер - Ваальс запропонував молекули реального газу уявити у вигляді твердих кульок з діаметром d, між якими діють сили взаємного притягування. Сили взаємного відштовхування враховуються шляхом використання розміру молекул.
Рівняння Ван – дер – Ваальса для одного моля газу можна записати у вигляді
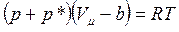
де 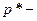 поправка, зумовлена дією сил взаємного притягування між молекулами (внутрішній тиск); b – поправка, що залежить від власного об’єму всіх молекул одного моля газу;
поправка, зумовлена дією сил взаємного притягування між молекулами (внутрішній тиск); b – поправка, що залежить від власного об’єму всіх молекул одного моля газу; 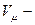 об’єм одного моля газу. Внутрішній тиск визначають за формулою
об’єм одного моля газу. Внутрішній тиск визначають за формулою 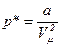 , де
, де 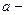 коефіцієнт Ван – дер – Ваальса, який залежить лише від хімічної природи газу. Поправка на власний об’єм молекул газу визначається за формулою
коефіцієнт Ван – дер – Ваальса, який залежить лише від хімічної природи газу. Поправка на власний об’єм молекул газу визначається за формулою 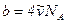 , де
, де 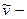 об’єм однієї молекули,
об’єм однієї молекули, 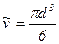 ,
, 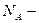 число Авогадро.
число Авогадро.
Таким чином, для одного моля газу 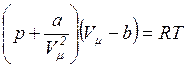 . Це рівняння вперше було виведене в 1873 р. Я. Ван – дер – Ваальсом і має його ім’я. Рівняння для будь-якої маси М газу отримаємо помноживши попереднє на кількість молей
. Це рівняння вперше було виведене в 1873 р. Я. Ван – дер – Ваальсом і має його ім’я. Рівняння для будь-якої маси М газу отримаємо помноживши попереднє на кількість молей 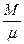 і врахувавши залежність
і врахувавши залежність 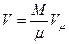 . Звідки
. Звідки
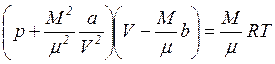
Це рівняння краще співпадає з результатами дослідів ніж рівняння Менделеева - Клапейрона. Але, для сильно стиснених газів це рівняння також виявляється недостатньо точним.
|
|
