
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Теплоємність реальних газів залежить від виду газу, характеру процесу, температури і тиску.
|
|
Технічні розрахунки виконують в основному за величиною середньої теплоємності.
Для приблизних розрахунків при невисокій температурі значення середніх теплоємностей Сm газів приймають незалежно від температури згідно з даними таблиць 2 і 3 за величиною мольних середніх теплоємностей μ Сm.
Таблиця 2
| Гази | Мольна теплоємність μ Сm, кДж/кмоль·гр | |
| Ізохорна μ Сυ | Ізобарна μ Ср | |
| Одноатомні (Аr, Не, Сl…) | 12, 56 | 20, 93 |
| Двохатомні (N2, О2, СО…) | 20, 93 | 29, 31 |
| Трьох- і багатоатомні (СО2, Н2О, SО2…) | 29, 31 | 37, 68 |
Основні співвідношення між указаними теплоємностями та деякі залежності для визначення кількості теплоти наведені в таблиці 3.
Якщо розрахунки q виконуються через об’ємну середню теплоємність 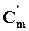 , то питома кількість теплоти q’ буде віднесена до 1м3 і має розмірність кДж/ м3.
, то питома кількість теплоти q’ буде віднесена до 1м3 і має розмірність кДж/ м3.
В адіабатному процесі теплообмін відсутній і кількість теплоти у такому процесі рівна нулю, qS =0. Таким чином, теплота є функція процесу.
Для m (кг) робочого тіла кількість теплоти розраховується згідно із залежністю
Q = m· q = m× Cm(t2 – t1), кДж,
де q – питома кількість теплоти, віднесена до 1 кг РТ, кДж/кг.
Для об’єму V, м3, кількість теплоти визначається через її питому кількість q¢, віднесену до 1 м3 робочого тіла
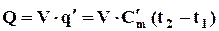 , кДж.
, кДж.
Якщо об’єм РТ (V) виразити через його масу, то
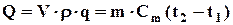 , кДж,
, кДж,
де m = V× ρ, кг; ρ – густина робочого тіла при відомих значеннях тиску Р і температури Т робочого тіла, кг/м3.
Якщо підставити секундні витрати робочого тіла mc (кг/с), то будуть одержані секундні витрати теплоти, що мають розмірність кДж/с = кВт,
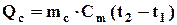 , кДж/с (кВт).
, кДж/с (кВт).
де q – питома кількість теплоти, необхідної для зміни температури 1кг робочого тіла від t1 до t2 при ізохорному qυ , ізобарному qр та політропному qп процесах, у кДж/кг.
Теплота – це енергія, яку робоче тіло отримує або віддає в процесах теплообміну без здійснення роботи. При Q > 0 теплота отримується, t2 > t1, а якщо Q < 0 – то віддається і t2 < t1. При t1 = t2 кількість теплоти Q = 0.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
При теплообміні між кількома РТ або РТ і навколишнім середовищем кількість теплоти, що віддається більш нагрітим тілом, Q1 дорівнює кількості теплоти, яку отримує холодніше тіло, Q2
Q1 = Q2; Q1 – Q2 = 0.
Таблиця 3
| № з/п | Вид теплоємності | Од. вимірювання | ІзохорнаСmυ | ІзобарнаСmр | ППолітропнаСmп | Об’ємна середня 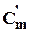
| Масова середняСm |
| Мольна середня μ Сm | 
| 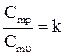  ,
k – показник адіабати ,
k – показник адіабати
| Сmр – Сmυ = R 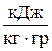 R – постійна газова стала
R – постійна газова стала
| μ Сm=Сm·μ | |||
Об’ємна середня
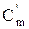 = μ Сm/22, 4 = μ Сm/22, 4
| 
| 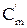 = Сm·ρ = Сm·ρ
| |||||
| Масова середня Сm= μ Сm/μ | 
| μ Сmр – μ Сmυ = Rμ, 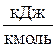
| Сm= 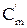 ·υ ·υ
| – | |||
| ізохорна, υ = const, Сmυ | 
| – | 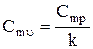
| qυ = Сmυ · (t2–t1), 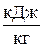
| |||
| ізобарна, Р= const, Сmр | 
| Сmр = Сmυ ·k | qр = Сmр· (t2–t1), 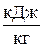
| ||||
| політропна, n= const, Сmп | 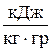
| Сmп= 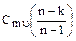
| qп = Сmп· (t2–t1), 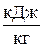
|
Залежність називається рівнянням теплового балансу. Воно покладено в основу всіх розрахунків, пов¢ язаних із передачею теплоти від одного робочого тіла до другого.
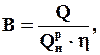 Кількість теплоти, що виділяється при повному спалюванні палива, називається теплотою згорання палива
Кількість теплоти, що виділяється при повному спалюванні палива, називається теплотою згорання палива 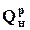 . За відсутності конденсації водяної пари, що входить до складу продуктів згорання, теплота згорання 1нм3 природного газу становить 36000–37000 кДж/нм3. Величина теплоти згорання збільшується за наявності у складі палива важких вуглеводнів. Теплота згорання використовується при визначенні витрат палива B, нм3, згідно з формулою (11) за відомою величиною кількості теплоти Q, кДж, що витрачається для здійснення будь-якого термодинамічного процесу, нм3/год:
. За відсутності конденсації водяної пари, що входить до складу продуктів згорання, теплота згорання 1нм3 природного газу становить 36000–37000 кДж/нм3. Величина теплоти згорання збільшується за наявності у складі палива важких вуглеводнів. Теплота згорання використовується при визначенні витрат палива B, нм3, згідно з формулою (11) за відомою величиною кількості теплоти Q, кДж, що витрачається для здійснення будь-якого термодинамічного процесу, нм3/год:
де 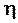 – ККД перетворення теплоти згорання палива у теплоту робочого тіла, дол.од.
– ККД перетворення теплоти згорання палива у теплоту робочого тіла, дол.од.
Робота є однією з форм передачі енергії при здійсненні термодинамічних процесів, у ході яких змінюється об’єм робочого тіла. При підведенні теплоти Q і розширенні РТ робота додатня, що ставиться за мету для більшості термодинамічних процесів. При зменшенні об’єму V і стискуванні РТ – робота від’ємна, що означає витрати зовнішньої роботи.
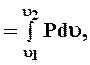 Величина роботи, пропорціональна тиску Р, зміні об’єму РТ, обчислюється за формулою
Величина роботи, пропорціональна тиску Р, зміні об’єму РТ, обчислюється за формулою
l кДж/кг,
де l – робота в термодинамічному процесі зміни питомого об’єму робочого тіла від υ 1 до υ 2, м3/кг;
Р – тиск у процесі, кПа.
Для маси m, кг, робота визначається за формулою
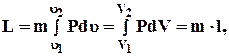 кДж.
кДж.
Для одержання максимальної роботи необхідно підвищувати тиск РТ і вибирати робочі тіла із значним питомим об’ємом (малою густиною). Формули, що застосовуються для визначення величини роботи, залежать від виду термо -
динамічного процесу і наведені у таблиці 5. Робота є функцією процесу.
Внутрішня енергія U, на відміну від роботи, залежить не від виду процесу, а є функцією термодинамічних параметрів, U= f (Р, υ, Т).
Для ідеального газу U= f (Т), оскільки сили міжмолекулярної взаємодії для ідеального газу відсутні.
Відповідно до сучасних фізичних поглядів внутрішня енергія є сумою кінетичної і потенціальної енергії молекул РТ. Температура Т визначає кінетичну енергію руху молекул, а від Р і υ залежить потенціальна енергія міжмолекулярної взаємодії.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Автор понять „внутрішня енергія” й „ентропія”, німецький фізик Р.Клаузис називав внутрішню енергію U „теплом, що міститься у робочому тілі”, проти поставляючи йому Q – „тепло, яке передається до робочого тіла”. Змінити внутрішню енергію робочого тіла можна при його взаємодії з іншими тілами або навколишнім середовищем. При цьому обмін масами РТ відсутній. Внутрішня енергія змінюється за рахунок підведення або відведення теплоти, здійснення над РТ роботи чи одночасно шляхом обміну і теплотою, і роботою. До сталого стану робочого тіла з певною внутрішньою енергією можна прийти, по-різному комбінуючи кількість теплоти і роботи, що передається до робочого тіла, залишаючи постійною лише їх суму.
Зміна внутрішньої енергії Δ Uп-к у термодинамічних процесах визначається як різниця внутрішніх енергій у кінцевій і початковій точках процесу
Δ Uк-п = Uк – Uп = Сmυ (Тк – Тп).
Величина внутрішньої енергії для ідеального газу з температурою t не- залежно від виду процесу обчислюється за формулою
U = Сmυ ·t, кДж/кг,
де t – температура ідеального газу, °C; Сmυ – ізохорна середня масова теплоємність газу, кДж/кг·гр.
Поняття “ ентальпія” було введене в термодинаміку Гіббсом як повна енергія робочого тіла, що складається із внутрішньої енергії U і потенціальної енергії рυ
і = U+ рυ = U + RT, кДж/кг.
Ентальпія має розмірність енергії і є функцією стану, оскільки залежить від параметрів стану робочого тіла (Р, υ, Т).
Для ідеальних газів силами міжмолекулярної взаємодії нехтують, тому ентальпія ідеального газу залежить тільки від температури і = f (Т) і визна-чається за залежністю
і = Сmр ·Т, кДж/кг,
де Т – температура робочого тіла за шкалою Кельвіна, 0К.
При виконанні практичних розрахунків із водяною парою температуру приймають за шкалою Цельсія й умовно вважають, що при температурі t = 0°C величина ентальпії РТ матиме нульове значення, і = 0. Це пояснюється переходом води у тверду фазу при t = 0 °C.
У теплотехнічних розрахунках, як правило, необхідно знати зміну ентальпії Δ і = ік – іп, а не її абсолютне значення, а тому початок відліку (°К чи °C) для кінцевого результату (Δ і) не має значення.
Для будь-якого термодинамічного процесу зміна ентальпії може бути записаною у диференціальній формі
dі = dU + d(рυ) = dU + рdυ + υ dр.
Оскільки dq = dU + dl, а dl = рdυ, то
dі = dq + υ dр,
а для ізобарного процесу, dр = 0
dі = dq,
Δ і = q = ік – іп = Сmр× (Тк –Тп),
де іп, ік – ентальпія відповідно у початковій та кінцевій точках ізобарного процесу, кДж/кг.
Ентропія була введена у термодинаміку теоретично, бо не існує інструментальних методів її вимірювання. Введення ентропії дало можливість установити зв’язок між температурою робочого тіла та кількістю теплоти і пояснити деякі фізичні явища. Наприклад, як пояснити, чому при фазових переходах реальних РТ підвищення теплоти не приводить до зміни температури тіла?
Якщо до ідеального робочого тіла спочатку підвести деяку кількість теп-
лоти Δ q1, а потім віддати деяку меншу кількість теплоти Δ q2 холодильнику, то в результаті буде виконана робота, на яку буде витрачена теплота Δ q0 = |Δ q1| – |Δ q2|. Теплота і температури нагрівача та холодильника для ідеального теплового двигуна зв’язані залежністю
Δ q1/Т1 = Δ q2/Т2, або Δ q1/Т1– Δ q2/Т2 = 0,
де знак «–»перед Δ q2 свідчить про те, що теплота віднімається від робочого тіла. Таким чином, у термодинамічних процесах ідеального теплового двигуна сталою є не кількість теплоти, одержаної Δ q1 чи втраченої Δ q2 РТ, а інша величина – теплота, що бере участь у процесі, поділена на температуру. При підведенні до РТ теплоти Δ q ця величина змінюється на величину Δ S, що визначається як
Δ S = Δ q/Т, кДж/кг× гр.
Величину „ S ” Клаузис назвав ентропією. Вона характеризує стан робочого тіла, як і Р, υ, Т.
|
|
