
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Задание 1. Влияние температуры на растворимость иодида свинца
|
|
В пробирку внесите по 2-3 капли растворов соли свинца (II) и иодида калия. Отметьте цвет полученного осадка. Добавьте 2-3 мл дистиллированной воды и осторожно нагрейте почти до кипения. Если осадка много, добавьте еще воды и продолжайте нагревать почти до полного его растворения. Поставьте пробирку в штатив и наблюдайте, как в процессе медленного охлаждения насыщенного раствора появляется осадок иодида свинца в крупнокристаллической форме. Запишите уравнение образования осадка в ионной и молекулярной форме. Запишите выражение ПР и найдите в справочнике его численное значение. Сделайте вывод о влиянии температуры на растворимость осадка.
Задание 2. Получение труднорастворимых гидроксидов
Осуществите следующие реакции, выбрав нужные реактивы, и сохраните осадки:
1. Ni2+ + 2OH- = Ni(OH)2¯ A13+ + 3NH3× H2O = A1(OH)3¯ + 3NH4+
2. Fe2+ + 2OH- = Fe(OH)2 ¯ Cr3+ + 3NH3× H2O = Cr(OH)3 ¯ + NH4+
3. Cu2+ + 2OH- = Cu(OH)2 ¯ Pb2+ + 2NH3× H2O = Pb(OH)2 ¯ + 2NH4+
4. Fe3+ + 3OH- = Fe(OH)3¯ Be2+ + 2NH3× H2O = Be(OH)2 ¯ + 2NH4+
Встряхните осадки, разделите их на две пробирки (или продублируйте реакцию получения гидроксида в другой пробирке). В первую прилейте равный объем разбавленной серной кислоты, во вторую – равный объем щелочи. Тщательно перемешайте содержимое пробирок. Растворились ли осадки?
Напишите ионно-молекулярные и молекулярные уравнения протекающих реакций, отметьте цвета осадков и растворов. Укажите характер гидроксидов. Для одного из осадков (по указанию преподавателя) запишите выражение для ПР и, используя его справочное значение, рассчитайте концентрацию ионов металла (моль/л) в насыщенном растворе этого осадка.
Задание 3. Получение труднорастворимых солей
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
В три пробирки внесите по 2-3 капли раствора хлорида бария, затем добавьте по 2-3 капли растворов следующих солей: в первую – сульфат натрия, во вторую – карбонат натрия, в третью – оксалат натрия (соль щавелевой кислоты Н2C2O4). Наблюдайте появление белых осадков во всех трех пробирках. Затем добавьте во все пробирки по 1 мл разбавленной хлористоводородной кислоты HCl, встряхните пробирки, наблюдайте растворение некоторых осадков. Какие это осадки? Почему не все осадки растворились?
Напишите ионно-молекулярные и молекулярные уравнения всех реакций. Сделайте общий вывод о направлении протекания ионообменных реакций с участием твердых фаз в водных растворах.
Задание 4. Условия перехода одного осадка в другой
Смешайте в пробирке по 2 капли растворов нитрата свинца и сульфата натрия, наблюдайте образование осадка, запишите его цвет. Затем в эту пробирку добавьте несколько капель раствора сульфида натрия Na2S и хорошо перемешайте. Отметьте изменение цвета осадка. Напишите уравнения протекающих реакций в ионном и молекулярном виде. Найдите в справочнике значения произведения растворимости сульфата и сульфида свинца, сравните их и сделайте вывод о направлении протекания реакций, связанных с переходом одного осадка в другой.
Подтвердите свой вывод расчетом константы равновесия данной реакции по формуле, приведенной ниже:
PbSO4¯ + S2- = PbS¯ + SO42-
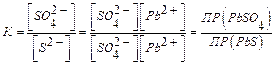
|
|
