
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Опытные законы идеального газа
|
|
В молекулярно-кинетической теории пользуются моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
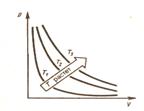 Закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
Закон Бойля-Мариотта: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
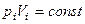 при Т =const, m =const
при Т =const, m =const
Кривая зависимости р от V при Т =const называется изотермой.
рис.15
Законы Гей-Люссака: 1) Объем данной массы газа при постоянном давлении изменяется линейно с температурой:
V=V0 (1 +α t) при p =const, m =const
 Более удобный вид:
Более удобный вид: 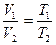 ,
,
Кривая зависимости V от Т называется изобарой.
рис.16
2) Давление данной массы газа при постоянном объеме линейно изменяется с температурой:
р=р0 (1+ α t) при V =const, m =const
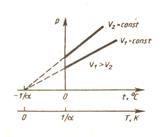 Более удобный вид:
Более удобный вид: 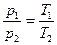 ,
,
где р0 и V0 – объем и давление при
0 0С, коэффициент α =1/273, 15 К-1
Кривая зависимости р от Т называется изохорой.
рис.17
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22, 41.10-3м3/моль. NA =6, 022.1023моль-1 – число молекул в одном моле вещества – постоянная Авогадро.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов:
 ,
,
где р1, р2 ….. рn – парциальные давления, давления, которые оказывали бы отдельные газы смеси, если бы они занимали объем, равный объему смеси при той же температуре.
Русский ученый Д.И. Менделеев и французский Клапейрон получили уравнение состояния идеального газа, связывающее вместе три термодинамических параметра системы:
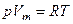
где Vm – молярный объем – объем одного моля газа, R – универсальная газовая постоянная, равная 8, 31 Дж/(моль.К). Для произвольной массы газа уравнение записывается в виде:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
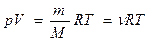
где М – молярная масса, 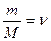 – количество вещества.
– количество вещества.
Существует еще одна форма записи этого уравнения:

где n – концентрация молекул газа, 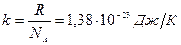 .
.
N A=6, 022.1023моль-1 - число Авогадро
|
|
