
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Этапы биосинтеза белка
|
|
Хотя построение первых моделей механизмов биосинтеза белка было начато еще в начале 1960-х гг., полное описание процесса трансляции далеко до завершения и в настоящее время. Ниже будут кратко рассмотрены основные черты классической модели биосинтеза белка рибосомами E. coli, а также особенности некоторых альтернативных моделей.
Процесс биосинтеза белка рибосомами, как и биосинтез любой другой макромолекулы клетки, условно разделяют на три основных этапа: инициацию, элонгацию и терминацию. Во время инициации трансляции происходит сборка нативной 70S или 80S рибосомы на транслируемой мРНК и подготовка к образованию пептидной связи между первыми двумя N-концевыми аминокислотными остатками синтезируемого полипептида. При элонгации наблюдается последовательное удлинение растущей цепи полипептида аминокислотными остатками, а терминация трансляции сопровождается прекращением синтеза полипептида и его высвобождением из трансляционного комплекса. При этом наблюдается также разделение рибосомы и мРНК, после чего они вступают в новый цикл трансляции. В ходе трансляции рибосома последовательно перемещается вдоль транслируемой молекулы мРНК, считывая заключенную в ней генетическую информацию в виде триплетного генетического кода. Трансляция начинается в 5’-концевой части мРНК, а завершается в ее 3’-концевой части. При этом биосинтез полипептида начинается с его N-концевой аминокислоты. Рассмотрим каждый из вышеперечисленных этапов более подробно на примере белоксинтезирующей системы E. coli.
Инициация трансляции. Биосинтез белка рибосомами начинается с образования комплекса между малой 30S субчастицей рибосом, инициаторной тРНК и участком транслируемой мРНК, содержащим сайт связывания рибосом, который включает в себя инициирующий (как правило, AUG) кодон. В образовании инициационного комплекса с 30S субчастицей принимают участие три белковых фактора инициации – IF1, IF2 и IF3. В ходе этого процесса расходуется одна молекула GTP, которая взаимодействует с IF2 и изменяет его конформацию (см. рис. I.19). Таким образом, на первом этапе образования инициационного комплекса происходит объединение свободной 30S субчастицы с факторами инициации и GTP, после чего с ними последовательно связываются мРНК и инициаторная тРНК (в случае E. coli, как правило, формилметионил(fMet)-тРНКfMet). Инициаторная тРНК строго специфична для этой стадии белкового синтеза. Сначала она обычным путем акцептирует Met с образованием Met-тРНКfMet, а затем специальная ферментная система E. coli формилирует NH2-группу остатка Met. Последовательность присоединения инициаторной тРНК и мРНК к 30S субчастице не имеет значения, что и отражено на рис. I.19 (стадии А, А’, В, В’).
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
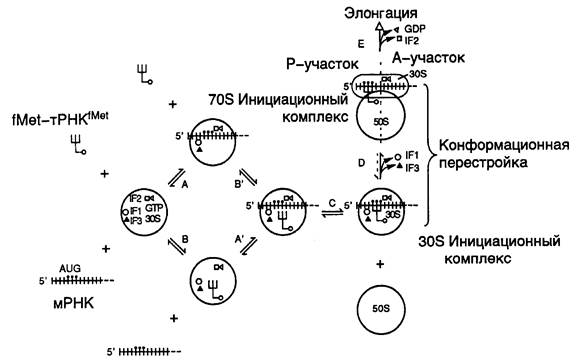
Рис. I.19. Этапы инициации трансляции у E. coli
Вначале после объединения факторов инициации трансляции, GTP, fMet-тРНКfMet и мРНК с 30S субчастицей антикодон тРНК еще не взаимодействует с инициаторным AUG-кодоном (стадии А’ и B’). Такое продуктивное взаимодействие тРНК с мРНК происходит в дальнейшем (стадия C), и этот переход является одной из лимитирующих стадий всего процесса образования инициационного комплекса. С завершением стадии C происходит формирование стабильного тройного (из трех основных компонентов) инициационного комплекса, сопровождаемое конформационными перестройками всех его компонентов. После выхода из комплекса факторов инициации трансляции IF1 и IF3 тройной комплекс приобретает способность связывать большую 50S субчастицу рибосом, что сопровождается дальнейшими конформационными перестройками всей рибосомы (стадия D). В ходе этого процесса происходит расщепление молекулы GTP до GDP и ортофосфата и освобождение из комплекса фактора IF2 (стадия E). Формилметионил-тРНКfMet вместе с инициирующим AUG-кодоном перемещаются в донорный (P) участок рибосомы, освобождая акцепторный (A) участок для следующей аминоацилированной тРНК. В результате инициационный комплекс становится полностью подготовленным для вступления в следующую фазу биосинтеза белка – элонгацию полипептидных цепей.
Элонгация. В соответствии с обсуждаемой моделью принято считать, что после образования тройного комплекса, включающего 70S рибосому, мРНК и инициаторную тРНК, завершается этап инициации трансляции, и процесс биосинтеза белка вступает в фазу элонгации, которая завершается освобождением полипептидных цепей из элонгирующих комплексов. Во время элонгации происходит последовательное присоединение аминокислотных остатков к C-концевым частям строящихся полипептидных цепей, направляемое кодонами транслируемых матричных РНК.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе

Рис. I.20. Элонгация полипептидных цепей
Стрелки указывают на реакции, подавляемые соответствующими антибиотиками
Этап элонгации начинается со взаимодействия фактора элонгации трансляции EF-Tu, молекулы GTP и очередной аминоацилированной тРНК с A-участком рибосомы (см. рис. I.20, стадия Е1). Вхождение аминоацилированной тРНК в A-участок происходит в соответствии с установленным в нем кодоном транслируемой мРНК. При этом лишь та аминоацилированная тРНК прочно связывается с рибосомой, у которой антикодон комплементарен кодону, установленному в A-участке. После гидролиза GTP и освобождения EF-Tu•GDP из комплекса (стадия Е2) происходит образование новой пептидной связи между карбоксильной группой формилметионина инициаторной тРНК и NH2-группой аминокислотного остатка, находящегося в A-участке рибосомы в составе аминоацил-тРНК (стадия Е3). Эта стадия получила название транспептидации. Обмен GDP на GTP в освободившемся комплексе EF-Tu•GDP происходит с участием фактора EF-Ts.
Образовавшийся в итоге пептид удерживается рибосомой через остаток тРНК, находящийся в A-участке, а освободившаяся тРНК временно сохраняется в так называемом E-участке рибосомы (от англ. exit – выход). Такая соединенная с пептидом тРНК получила название пептидил-тРНК. Образовавшаяся пептидил-тРНК далее переносится из A- в P-участок рибосомы. Эта стадия элонгации (Е4) известна под названием транслокации. Транслокация индуцируется фактором элонгации EF-G, который освобождается из элонгирующего комплекса после расщепления молекулы GTP. Таким образом, энергия еще одной молекулы GTP используется в акте транслокации. После завершения транслокации происходит освобождение фактора EF-G из элонгирующего комплекса. При этом A-участок рибосомы остается свободным. Следующий цикл элонгации начинается с вхождения в A-участок рибосомы в составе тройного комплекса очередной молекулы тРНК (стадия Е1), что сопровождается освобождением формилметионил-тРНКfMet из E-участка, после чего повторяются все остальные вышеперечисленные стадии элонгации. В физиологических условиях рибосома совершает ~ 20 циклов элонгации в секунду. В соответствии с этим для синтеза белка длиной в 200 аминокислотных остатков требуется ~10 секунд.
В рассмотренной классической модели биосинтеза белка с тремя участками связывания тРНК на любой стадии элонгации с рибосомой взаимодействуют две молекулы тРНК. Иными словами, до стадии транслокации тРНК занимают A- и P-участки рибосомы, тогда как после транслокации молекулы ассоциированы с P- и E-участками. Между участками A и E существует аллостерическое взаимодействие, что проявляется в отрицательном кооперативном эффекте связывания молекул тРНК этими участками и означает, что только A- или E-участки рибосомы могут быть заняты молекулой тРНК, и рибосома не содержит одновременно занятыми оба участка.
Молекулярная мимикрия фактора элонгации EF-G. Недавно было обнаружено, что пространственная структура домена IV полипептидной цепи фактора элонгации EF-G имитирует структуру тРНК в ее комплексе с другим фактором элонгации EF-Tu. При этом структура соответствующей части полипептидной цепи EF-G напоминает форму антикодоновой петли тРНК в комплексе с фактором элонгации, ее положение относительно к ó ровой части EF-Tu и даже распределение электростатических зарядов на поверхности полипептида, которое соответствовало таковому углевод-фосфатного остова тРНК. Это открытие позволило по-новому посмотреть на механизм действия EF-G в цикле трансляции. Такого рода данные позволили предположить, что домен IV фактора EF-G занимает во время некоторых этапов транслокации ту же часть A-участка рибосом, что и тРНК. Однако остается непонятным, каким образом это может физически влиять на прохождение акта транслокации.
Терминация трансляции. Процесс трансляции вступает в завершающую фазу после того, как в A-участок рибосомы попадает терминирующий (бессмысленный) кодон мРНК, а пептидил-тРНК перемещается в донорный P-участок рибосомы. Белковые факторы RF1 и RF2 участвуют в распознавании последовательностей нуклеотидов терминирующего кодона. Фактор RF3, также как и EF-G, имитирует структурные особенности фактора EF-Tu, что дает ему возможность взаимодействовать с А-участком рибосомы. Но поскольку с ним не связана аминоацилированная тРНК, его присутствие в А-участке приводит к обрыву строящейся цепи полипептида. После формирования такого комплекса происходит расщепление сложноэфирной связи между полипептидом и тРНК, а также освобождение синтезированного полипептида. С помощью мутационного анализа было установлено, что молекулы рРНК обеих субчастиц рибосом E. coliучаствуют в гидролизе пептидил-тРНК.
Для того чтобы рибосома оставшегося комплекса рибосома–мРНК–тРНК могла вступить в следующий цикл трансляции, она должна освободиться из него. Установлено, что вышеупомянутые рибосомные рилизинг-факторы (RF) совместно с фактором EF-G при участии молекулы GTP обеспечивают диссоциацию комплекса на составные компоненты, которые затем вступают в новый раунд белкового синтеза. Фактор RF4 (иначе называемый RRF – ribosome-recycling factor) не имеет аналога у эукариот. Его роль, по-видимому, заключается в стимуляции перемещения молекулы деацилированной тРНК из P-участка в E-участок рибосомы и(или) удалении оставшегося RF-фактора из A-участка. Это способствует полному освобождению рибосомы и ее вовлечению в новый цикл трансляции в результате инициации или реинициации синтеза белка. Отделившаяся от мРНК рибосома перед вступлением в новый цикл диссоциирует на две субчастицы под действием фактора инициации трансляции IF3. Альтернативно, в том случае, если новый инициирующий кодон полицистронной матрицы находится достаточно близко от стоп-кодона, синтез белка может быть реинициирован.
Реинициация трансляции. Реинициацией трансляции называют повторное вступление рибосом, терминировавших биосинтез белка, в цикл трансляции без предварительного отделения их от мРНК. Реинициация синтеза белка широко распространена у E. coliи играет важную роль в контроле экспрессии генов этого микроорганизма на уровне трансляции. Это связано с тем, что значительная часть бактериальных мРНК полицистронна, а, следовательно, за терминирующим кодоном одного цистрона на небольшом от него удалении располагается инициирующий кодон следующего. Благодаря реинициации имеет место координированная (сопряженная) трансляция нескольких ОРС, объединенных в полицистронной матрице.
Имеются данные о том, что рибосомы E. coli, терминировавшие синтез полипептида, обладают способностью перемещаться на короткие расстояния в окрестностях терминирующего кодона и после встречи с инициирующим кодоном в новом сайте инициации трансляции могут начать следующий раунд трансляции без отделения от мРНК. Новый инициирующий кодон может располагаться выше или ниже стоп-кодона предыдущего гена, а может и перекрываться с ним (например, в последовательности AUGA). Реинициация может происходить с полной эффективностью, если в сайте реинициации имеется адекватная SD-последовательность, а терминирующий и инициирующий кодоны расположены достаточно близко друг к другу (менее эквивалента длины рибосомы). Последнее обстоятельство указывает на быструю кинетику отделения терминировавших рибосом от мРНК.
Важным следствием сопряжения трансляции у прокариот через реинициацию является зависимость экспрессии целой серии генов, принадлежащих одному оперону, от трансляции первой ОРС полицистронной матрицы. При этом следует заметить, что сопряжение экспрессии генов на уровне трансляции может оказывать и негативное влияние на эффективность трансляции нижерасположенных цистронов.
Если обычная инициация трансляции у E. coli на кодоне UUG происходит с очень низкой эффективностью, то реинициирующие рибосомы используют его для начала синтеза белка весьма охотно. Это объясняют отсутствием фактора IF3 в реинициирующем комплексе, который во многом определяет точность выбора инициирующего кодона рибосомами.
На поведение рибосом, терминировавших синтез белка, большое влияние оказывают и факторы терминации трансляции (RF). В опытах с мутантным бактериофагом R17, содержащим амбер-кодон в положении 7 гена белка оболочки, было установлено, что в отсутствие фактора терминации трансляции RF4 вслед за терминацией трансляции на бессмысленном кодоне имела место реинициация трансляции на следующем кодоне мРНК, что завершалось синтезом белка оболочки, укороченного с N-конца на 7 аминокислот. На этом основании полагают, что рилизинг-фактор RF4 в обычных условиях предотвращает распознавание аминоацилированной тРНК кодона, находящегося в А-участке рибосомы, который в мРНК следует за терминирующим.
Альтернативные модели цикла трансляции. В рассмотренной выше классической модели трансляции перемещение молекул тРНК на большой и малой субчастицах рибосом сопряжено друг с другом. В отличие от этого, в активно обсуждающейся модели гибридных состояний (hybrid states model) перемещение тРНК между A- и P-участками 30S субчастицы происходит независимо от перемещения тРНК между A-, P- и E-участками большой субчастицы. В соответствии с этой моделью аминоацил-тРНК попадает в пептидил-тРНК–рибосомный комплекс в составе тройного комплекса EF-Tu·GTP·тРНК и взаимодействует с ней первоначально в гибридном состоянии A/E. В этом состоянии антикодоновая часть тРНК связывается с A-участком 30S субчастицы, а ее CCA-конец, удерживаемый EF-Tu, располагается в E-участке большой субчастицы и, возможно, частично на малой субчастице. Вслед за гидролизом GTP происходит освобождение EF-Tu, что делает возможным перемещение CCA-конца аминоацил-тРНК в A-участок большой субчастицы, приводящее к возникновению A/A-состояния, эквивалентного состоянию взаимодействия аминоацил-тРНК с A-участком в классической модели. После образования пептидной связи аминоацил-тРНК, уже связанная с растущей полипептидной цепью, перемещается в P-участок большой субчастицы, а деацилированная тРНК переходит в E-участок большой субчастицы. Вновь образованная пептидил-тРНК находится теперь в гибридном A/P-состоянии: антикодоновая часть остается в A-участке 30S субчастицы, а CCA-конец занимает P-участок большой субчастицы рибосом. При этом деацилированная тРНК находится в гибридном P/E-состоянии: антикодоновый конец остается в P-участке малой субчастицы, тогда как CCA-конец занимает E-участок большой субчастицы. Далее фактор элонгации EF-G в GTP-зависимой реакции обеспечивает перемещение антикодоновой части тРНК, находящейся в гибридном состоянии, вместе с мРНК относительно 30S субчастицы. При этом пептидил-тРНК переходит в чувствительное к пуромицину P/P-состояние, соответствующее ее взаимодействию с P-участком в классической модели, а деацилированная тРНК находится в E-состоянии и на этом этапе трансляции может взаимодействовать только с E-участком большой субчастицы рибосом.
По крайней мере, три интересных следствия вытекают из модели гибридного состояния. Во-первых, пептидильная часть растущего пептида остается на рибосомах в стационарном состоянии, а во время трансляции перемещается тРНК. Во-вторых, транслокация тРНК происходит в два этапа: во время первой стадии обе молекулы тРНК движутся относительно большой субчастицы, на втором этапе обе молекулы тРНК вместе со связанной с ними мРНК перемещаются относительно малой 30S субчастицы рибосом. В-третьих, в процессе синтеза белка имеют место не два или три состояния связывания тРНК, а шесть или даже, возможно, семь таких состояний.
С помощью физических методов были получены прямые доказательства спонтанного прохождения стадии транслокации, опосредуемой пептидилтрансферазой рибосом. При использовании флуоресцентных зондов, связанных с различными участками тРНК и рибосом, удалось обнаружить изменения в квантовом выходе флуоресценции и анизотропные эффекты при образовании пептидной связи, что указывало на перемещение молекулы тРНК относительно рибосомных белков S21 и L11. На основании этих данных было высказано предположение, что во время пептидилтрансферазной реакции пептидильная цепь остается в постоянном положении относительно рибосомы, а перемещаются молекулы тРНК. Эта модель пептидилтрансферазной реакции получила название модели перемещения (displacement model). Она обладает многими общими чертами с моделью гибридного состояния, однако отличается тем, что в этой модели движение мРНК в пептидилтрансферазной реакции сопровождает перемещение тРНК.
Замечания о точности трансляции. Сама по себе стабильность кодон–антикодоновых взаимодействий не может обеспечивать наблюдаемую высокую точность трансляции. Рибосомы активно участвуют в акте распознавания молекулами тРНК соответствующих кодонов мРНК, повышая точность функционирования этого механизма, по крайней мере, на четыре порядка. Данный эффект объясняют функционированием механизмов, корректирующих ошибки на этом этапе трансляции, которые сопряжены с EF-Tu-зависимым гидролизом GTP во время выбора соответствующей аминоацилированной тРНК. Недавние измерения скорости гидролиза GTP рибосомами в присутствии правильной (cognate) или неправильной (noncognate) тРНК и искусственной матрицы показали, что в первом случае она выше в ~ 104 раз. Это приводит к преимущественному освобождению комплекса EF-Tu·GDP из рибосом, содержащих правильные аминоацил-тРНК в А-участке. Для реализации данного механизма рибосомы должны распознавать правильные и ошибочные кодон-антикодоновые взаимодействия, а также передавать эту информацию своему GTPазному центру.
Мутантные рибосомы, для которых характерна пониженная точность трансляции, как правило, обладают более высоким сродством к тРНК в A-участке. Напротив, у " сверхточных" рибосом такое сродство понижено. В соответствии с этим повышенную точность трансляции можно объяснять в терминах уменьшения неспецифического связывания аминоацилированных тРНК A-участком рибосом и vice versa. Недавно было показано, что сродство тРНК к P-участку таких мутантных рибосом изменяется на противоположное таковому A-участка: у ram-мутантов с низкой точностью трансляции наблюдается пониженное сродство P-участка к тРНК, а у " сверхточных" рибосом это сродство повышено. Таким образом, в настоящее время полагают, что простые реципрокные отношения связывают A- и P-участки рибосом с механизмами, которые управляют взаимодействием мРНК и соответствующих тРНК с рибосомами.
Новая 10Sa РНК, функционирующая в трансляции. В том случае, если транслируемая бактериальная мРНК укорочена в своей 3’-концевой части и рибосома не находит в соответствующей рамке считывания терминирующий кодон, она не может закончить трансляцию с помощью стандартного механизма терминации. Полагают, что, столкнувшись с такой ситуацией, рибосома останавливается на конце мРНК и с ней взаимодействует недавно открытая 10Sa РНК, кодируемая у E. coli геном ssrA, которая запускает процесс деградации частично синтезированного полипептида. Эта необычная РНК, аминоацилированная остатком Ala на своем 3’-конце, подобном стандартной акцепторной последовательности тРНК, сочетает в себе свойства тРНК и мРНК. 10Sa РНК, как и тРНКAla, образует внутреннюю пару оснований G3: U70, которая необходима для специфического распознавания тРНКAla рибосомами. После взаимодействия с рибосомой эта РНК вступает в стандартный цикл трансляции: ее остаток Ala включается в недостроенную цепь полипептида. Вслед за этим рибосома транслирует короткую последовательность нуклеотидов 10Sa РНК, которая теперь функционирует в качестве матрицы, добавляя десять аминокислот – ANDENYALAA – в C-конец укороченной полипептидной цепи, и терминирует трансляцию на UAA-кодоне 10Sa РНК. C-Концевая олигопептидная последовательность освободившегося полипептида далее распознается специфической протеиназой, которая расщепляет этот полипептид, обеспечивая его утилизацию бактериальной клеткой в процессе катаболизма.
|
|
