
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Механизм прямой и обратной реакций аутосплайсинга
|
|
Интронов группы I
| Аутосплайсинг | Обратное лигирование |
GTPOH
+
[Экзон 1]upA- Интрон -Gpa[Экзон 2]
↓
 Расщепление
5’-концевого сайта
сплайсинга
↓
[Экзон 1]u-OH
GpA- Интрон -Gpa[Экзон 2]
↓ Расщепление
5’-концевого сайта
сплайсинга
↓
[Экзон 1]u-OH
GpA- Интрон -Gpa[Экзон 2]
↓  Лигирование
экзонов
↓
[Экзон 1]upa[Экзон 2]
+
GpA- Интрон -G
Лигирование
экзонов
↓
[Экзон 1]upa[Экзон 2]
+
GpA- Интрон -G
|
GTPOH
+
[Экзон 1]upA- Интрон -Gpa[Экзон 2]
↑
 Интеграция
интрона в
прежнее место
↑
[Экзон 1]u-OH
GpA- Интрон -Gpa[Экзон 2]
↑ Интеграция
интрона в
прежнее место
↑
[Экзон 1]u-OH
GpA- Интрон -Gpa[Экзон 2]
↑  Лигирование
экзона 2 и интрона
↑
[Экзон 1]upa[Экзон 2]
+
GpA- Интрон -G
Лигирование
экзона 2 и интрона
↑
[Экзон 1]upa[Экзон 2]
+
GpA- Интрон -G
|

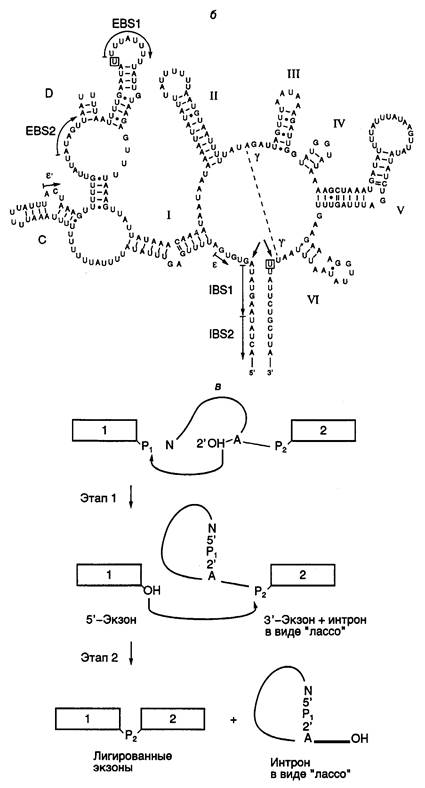
Рис. I.15. Структура интронов I-III групп и механизм аутосплайсинга
а – вторичные структуры типичных интронов типа I (Tetrahymena thermophila), II и III групп (Euglena gracilis). Стрелками обозначены 3¢ - и 5¢ -сайты сплайсинга, а также места интеграции твинтронов, пунктирными линиями – сайты интронов, сближенные в пространстве, EBS и IBS – соответственно сайты связывания экзонов и интронов; б – предполагаемая вторичная структура интрона группы II; в – двухэтапный механизм аутосплайсинга. Римскими цифрами обозначены предполагаемые двухцепочечные участки РНК, 1, 2 – экзоны
Строчными буквами в таблице изображены нуклеотиды, принадлежащие экзонам, а прописными – интронам. Прямая и обратная реакции не требуют белковых катализаторов. Однако в ряде случаев интроны I и II групп могут кодировать полипептид, названный матуразой (maturase, от англ. mature – созревать), который необходим для эффективного аутосплайсинга и транспозиции интронов in vivo.
Аутосплайсинг интронов группы I начинается с нуклеофильной атаки 2’-OH-группы GTP по фосфодиэфирной связи в 5’-концевом сайте сплайсинга (см. табл. I.10) (присутствие GTP в качестве кофактора необходимо для протекания данной реакции). При этом происходит освобождение 5’-концевого экзона 1. Образовавшиеся половинки молекулы удерживаются рядом друг с другом водородными связями. Освободившаяся 3’-OH-группа экзона 1 далее атакует фосфодиэфирную связь в 3’-концевом сайте сплайсинга, что сопровождается расщеплением этой связи и полным освобождением интрона. Одновременно происходит лигирование двух экзонов. Все этапы этой реакции обратимы. В обратной реакции после связывания соответствующего участка лигированных экзонов " активным центром" вырезанного интрона последний атакует своей концевой 3’-OH-группой фосфодиэфирную связь в месте стыковки экзонов, что сопровождается объединением интрона и экзона 2. На втором этапе 3’-OH-группа экзона 1 атакует фосфатную группу по первой фосфодиэфирной связи интрона, освобождая остаток G, с последующим объединением экзона 1 с остальной частью молекулы.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Аутосплайсинг интронов II и III групп протекает по другому механизму (см. рис. I.15, в). Реакция также осуществляется в два этапа. На первом этапе 2’-OH-группа аденозина, находящегося в точке разветвления интрона, вырезаемого из предшественника РНК, атакует фосфодиэфирную связь 5’-концевого сайта сплайсинга, что сопровождается освобождением экзона 1 и образованием промежуточной структуры в виде лассо. В таком промежуточном соединении 5’-концевой нуклеотид интрона соединен 2’–5’-фосфодиэфирной связью с этим остатком аденозина, образуя петлю на конце интрона. На втором этапе 3’-концевая OH-группа экзона 1 атакует 3’-концевой сайт сплайсинга. В результате происходит объединение экзонов и освобождается интрон с петлей на 5’-конце. В заключение следует отметить одно замечательное свойство этой группы реакций. Поскольку число фосфодиэфирных связей на протяжении всех преобразований остается неизменным, они не требуют затраты дополнительной энергии и протекают самопроизвольно.
Сплайсинг у ядерных пре-мРНК. Исследование механизмов сплайсинга у ядерных пре-мРНК показало, что они существенно не отличаются от только что рассмотренных механизмов, используемых для удаления интронов II и III групп, однако ряд различий имеется.
Структура интронов, удаляемых из предшественников РНК аутосплайсингом, высококонсервативна. У интронов ядерных РНК консервативны лишь короткие последовательности в окрестностях сайтов сплайсинга и точки разветвления. Вторая отличительная особенность сплайсинга у ядерных пре-мРНК – потребность в ATP и мяРНП, формирующих сплайсому. Тем не менее, одинаковые черты этих двух систем сплайсинга более существенны. Малые ядерные РНК, входящие в состав мяРНП и сплайсомы, участвуют в распознавании сайтов сплайсинга и точки разветвления, а также в правильном ориентировании экзонов по отношению друг к другу. Их OH-группы осуществляют атаку фосфодиэфирной связи 5’-концевого сайта сплайсинга на первом этапе реакции. Так же как и в случае интронов II и III групп, для вырезаемого интрона характерна структура типа лассо.
Распознавание канонических сайтов при сплайсинге ядерных пре-мРНК. Для полного прохождения всех реакций сплайсинга его аппарат (сплайсома) должен распознавать на пре-мРНК три критические последовательности нуклеотидов: 3’- и 5’-концевые сайты сплайсинга и точку разветвления. В соответствии с наиболее распространенной моделью поиска экзонов в пре-мРНК с большими интронами, аппарат сплайсинга, прежде всего, отыскивает два близкорасположенных сайта сплайсинга в нужной ориентации. Распознавание конкретной пары сайтов сплайсинга в пре-мРНК дрожжей начинается с взаимодействия по принципу комплементарности между последовательностями этих сайтов и 5’-концевыми участками мяРНК U1, входящих в состав U1-мяРНП-частиц в случае 5’-концевых сайтов сплайсинга, а также белка U2AF65, находящегося в комплексе с U2AF35, с последовательностью 3’-концевого сайта сплайсинга. Эффективность функционирования сайтов сплайсинга зависит от степени соответствия их первичной структуры консенсусным последовательностям.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Сближение двух сайтов сплайсинга, сопровождаемое выпетливанием последовательности интрона, осуществляется с участием SR-белков, обогащенных Ser и Arg, которые взаимодействуют с 70К-белком (70 кДа), входящим в состав U1-мяРНП-частицы, а также U2AF35 на другом конце интрона. Такие комплексы, образованные с участием SR-белков, получили название " коммитированных комплексов ".
В то время как 5’-концевые сайты сплайсинга довольно консервативны, 3’-концевые сайты обнаруживают большую вариабельность. U1-мяРНП, находящиеся в комплексе с 5’-концевым сайтом сплайсинга, стимулируют присоединение белков U2AF к 3’-концевому сайту и способствуют правильному распознаванию соответствующего экзона в процессе, получившем название " определение экзона ". Эффективное распознавание сайтов сплайсинга соответствующими белками является критическим этапом в правильном и упорядоченном удалении экзонов из пре-мРНК в процессе конститутивного сплайсинга.
Механизмы определения экзонов. Гены позвоночных, как правило, содержат большое число мелких экзонов (средняя длина ~ 137 п.о.), разделенных протяженными последовательностями интронов, длина которых может превышать 100 т.п.о. При этом ферментные системы, осуществляющие сплайсинг, должны распознавать небольшие экзоны, затерянные среди гигантских некодирующих последовательностей, и осуществлять их правильное объединение друг с другом. Как уже упоминалось выше, канонические (консенсусные) последовательности, необходимые для распознавания экзонов, располагаются на концах интронов. Однако в отличие от соответствующих последовательностей интронов дрожжей регуляторные последовательности в окрестностях сайтов сплайсинга животных менее консервативны, и это, на первый взгляд, значительно усложняет задачу распознавания экзонов системами сплайсинга. В действительности распознавание индивидуальных сайтов сплайсинга у животных, по-видимому, не связано с независимым распознаванием канонических последовательностей в окрестностях каждого экзона. В соответствии с наиболее популярной в настоящее время моделью

Рис. I.16. Механизм определения экзонов и интронов при сплайсинге ядерных пре-мРНК
а – определение экзонов; б – определение интронов у позвоночных (1) и низших эукариот (2), в – роль кэп-связывающего комплекса (CBC) в определении экзонов. Отмечены белки и РНК, участвующие в этом процессе в составе сплайсом: 1 – белки, 2 и 3 – мяРНП, X – мутации, инактивирующие сайты сплайсинга; + – взаимодействия, обеспечивающие распознавание экзонов; AAUAAA – поли(А)-сайт
определения экзонов у животных, взаимодействие между соседними сайтами сплайсинга в генах с короткими экзонами и длинными интронами происходит не через интроны, а через последовательности экзонов. Предполагается, что у пре-мРНК с длинными интронами система сплайсинга, прежде всего, отыскивает пару близкорасположенных сайтов сплайсинга, фланкирующих короткие последовательности экзонов (рис. I.16, а). После распознавания такой пары с ними взаимодействуют U1- и U2-мяРНП и ассоциированные факторы сплайсинга, включая факторы, распознающие 3’-концевые сайты сплайсинга – U2AF и SC35, а также фактор, узнающий 5’-концевой сайт сплайсинга – ASF/SF2. После завершения процесса определения экзона соседние экзоны входят в контакт друг с другом в результате взаимодействия между факторами, распознающими индивидуальные экзоны. Таким образом, в соответствии с этой моделью процесс сборки активной сплайсомы у позвоночных проходит в два этапа, включающие определение экзонов и их сближение между собой. В генах с небольшими интронами, например у низших эукариот, по-видимому, реализуется альтернативный механизм (см. рис. I.16, б). В этом случае первым этапом сборки сплайсомы является определение интрона.
В результате мутаций, связанных с нарушением сплайсинга, возникает, по крайней мере, четыре фенотипа: игнорирование экзона, который вырезается вместе с интронами; активация новых (криптических) сайтов сплайсинга; возникновение внутри интронов псевдоэкзонов, последовательности которых не вырезаются из пре-мРНК, и игнорирование интронов. Частоты этих мутаций составляют соответственно 51, 32, 11 и 6%. Все фенотипы, за исключением последнего, могут быть объяснены на основе обсуждаемой модели определения экзонов.
Эта же модель позволяет предсказывать максимальные и минимальные размеры экзонов в генах эукариот. Действительно, анализ длин 1600 внутренних экзонов показал, что только 3, 5% из них содержат более 300 нуклеотидов и менее 1% – 400 нуклеотидов. Кроме того, доля экзонов, длина которых меньше 50 нуклеотидов, в этой выборке также незначительна. Известно, что в опытах in vitro сплайсинг резко ингибируется, если длина внутренних экзонов превышает 400 нуклеотидов или становится меньше 50 нуклеотидов. Все эти факты делают модель определения экзонов весьма правдоподобной. Более короткие экзоны, длина которых составляет 6 или 7 п.о., часто обнаруживаемые в генах белков мышц, распознаются системой сплайсинга через энхансерные регуляторные последовательности, расположенные в интронах рядом с экзонами. Механизм распознавания очень длинных экзонов остается неизвестным.
|
|
