
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Редактирование РНК у животных и их вирусов
|
|
| Организм, ткань | Локализация | РНК-субстрат | Последствия редактирования |
| Печень/кишечник крыс | Ядро | APOB-мРНК | C®U (CAAGlu®UAASTOP) |
| Мозг человека и грызунов | » | мРНК рецепторов AMPA и KA | A®I (CAGGlu®CGGArg) |
| Семенники человека, нормальные и опухолевые ткани крыс | » | мРНК опухоли Вилмса 1 | U®A (CUCLeu®CCCPro) |
| Мышцы человека | ? | мРНК a-галактозидазы | U®A (TTCPhe®TACTyr) |
| Опухоли человека | Ядро | мРНК нейрофиброматоза типа 1 | C®U (CGAArg®UGASTOP) |
| Печень крыс | » | тРНКAsp | C®U и U®C рядом с антикодоновой петлей |
| Сумчатые | Митохондрии | тРНКGly | C®U в антикодоне (Gly®Asp) |
| Вирус гепатита d | Вирус | Антигеномная РНК | A®I (UAGSTOP®UGGTrp) |
| Парамиксовирусы | » | Ген Р | Вставки G |
| Вирус Эбола | » | Ген гликопротеина | Вставки А |
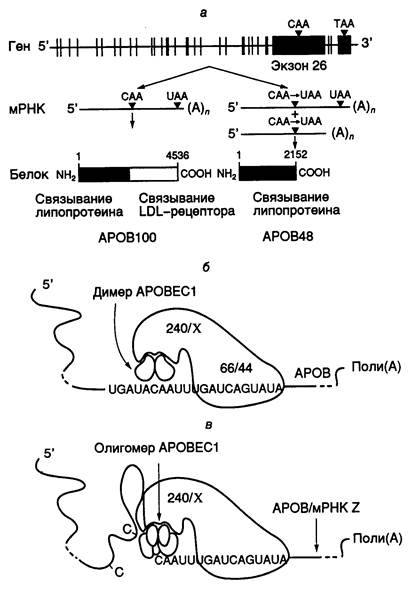
Рис. I.11. Экспрессия гена APOB человека и механизм редактирования его мРНК
а – схема экспрессии гена; б – механизм дезаминирования остатка C в APOB-мРНК в результате редактирования с участием эдитосомы; в – нарушение специфичности редактирования APOB-мРНК при олигомеризации каталитической субъединицы APOBEC1. В этих условиях субстратом для эдитосомы могут быть другие мРНК (мРНК Z)
мРНК длиной в семь т.о. В результате трансляции редактированных мРНК образуется укороченный ApoB48 (241 кДа), который содержит 2152 N-концевых аминокислотных остатка ApoB100. В функциональном отношении этот белок остается полностью активным, однако у него отсутствует С-концевой домен ApoB100, который отвечает за связывание с рецептором липопротеинов низкой плотности. Молекулярным механизмом редактирования ApoB-мРНК является сайт-специфическое дезаминирование цитозина с помощью цитидиндезаминазы. Недавно клонировали ген, кодирующий этот фермент у человека, и полностью определили его первичную структуру. Показано, что цитидиндезаминаза человека, осуществляющая редактирование ApoB-мРНК, представляет собой димер, построенный из двух идентичных субъединиц (АРОВЕС1) с молекулярной массой 28 кДа. Ген фермента, расположенный на хромосоме 12, экспрессируется исключительно в тонком кишечнике. Специфичность дезаминирования остатка цитозина определяется, по крайней мере, двумя факторами: последовательностью нуклеотидов мРНК в окрестностях этого сайта и белковыми кофакторами, взаимодействующими с каталитической субъединицей цитидиндезаминазы. Перенос методами генной инженерии последовательности нуклеотидов, фланкирующей сайт редактирования, в новые мРНК приводил к тому, что новые рекомбинантные РНК также подвергались специфическому редактированию in vivo и in vitro. В экспериментах такого рода, а также путем замен отдельных нуклеотидов методами направленного мутагенеза определили последовательность нуклеотидов мРНК, отвечающую за специфичность редактирования. Оказалось, что для оптимального осуществления этого процесса необходима последовательность длиной в 55 нуклеотидов, однако и 25 нуклеотидов в окрестностях сайта было достаточно, чтобы редактирование осуществлялось in vitro с 25%-ной эффективностью. Ниже представлены последовательности нуклеотидов в окрестностях сайтов редактирования, которые оказались высокогомологичными у разных видов млекопитающих.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
С→ U * * ** * * * * *
Человек Сайт 1 GAUA С AAUU UGAUСAGUAUA UUAAAG
Сайт 2 aAaA С AAUссaUGAUСuaсAUuUguuua
Бабуин Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG
Свинья Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG
Кролик Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG
Крыса Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAgAG
Мышь Сайт 1 GAUA С AAUU UGAUСAGUAUAUUAAAG
Звездочками обозначены нуклеотиды, замены которых с помощью направленного мутагенеза наиболее резко снижали эффективность редактирования, а строчными буквами отмечены негомологичные нуклеотиды. Подчеркнута последовательность нуклеотидов, получившая название якорной последовательности (mooring sequence). Эта последовательность является единственным цис- действующим регуляторным элементом, присутствие которого необходимо и достаточно для специфического редактирования вышерасположенного остатка С в экспериментах in vitro. Редактирование ApoB - мРНК здесь происходит после удаления из нее интронов в результате сплайсинга. Эффективность редактирования в таких системах зависит от нуклеотидных последовательностей в окрестностях этого сайта. В частности, АТ-богатые последовательности без выраженной вторичной структуры, фланкирующие якорную последовательность, стимулируют редактирование APOB-мРНК.
В связи с тем, что простая 11-звенная якорная последовательность определяет нуклеотид, который редактируется в этой системе, возникает вопрос о дополнительных факторах, которые требуются для обеспечения специфичности функционирования системы редактирования, зависимой от присутствия якорной последовательности. Действительно, перемещение якорной последовательности in vitro к любому остатку C на расстояние трех–четырех нуклеотидов от него в направлении 3’-конца РНК обеспечивает его редактирование in vivo. Предполагается, что в эдитосомах, осуществляющих редактирование ApoB-мРНК, соблюдается определенное соотношение между содержанием APOBEC1-субъединиц и дополнительных факторов-помощников (см. рис. I.11, б). В этой части рисунка показана гипотетическая структура нормальной эдитосомы, осуществляющей редактирование АРОВ-мРНК. Такая эдитосома включает собственно каталитический димер, два полипептида с молекулярными массами 66 и 44 кДа, необходимыми для специфического взаимодействия эдитосомы с якорной последовательностью, а также сопутствующие факторы Х, ассоциированные с белком AUX240 (240 кДа), который регулирует эффективность редактирования мРНК, обеспечивая сборку эдитосомы из белковых компонентов.
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Сверхэкспрессия APOBEC1-субъединицы в клетках, достигаемая генно-инженерными методами, приводит к изменению специфичности редактирования. Это было объяснено нарушением стехиометрических соотношений между молекулами субъединиц и дополнительными факторами, обеспечивающими специфичность редактирования (см. рис. I.11, в). На рисунке показано, что избыток субъединицы АРОВЕС1 в эдитосоме стимулирует ее к редактированию вышерасположенных остатков С в АpoВ-мРНК, поскольку изменяется характер фолдинга 5’-концевой части редактируемой мРНК. В результате другие остатки С становятся доступными для каталитических субъединиц.
В соответствии с вышеизложенным, все известные в настоящее время формы редактирования пре-мРНК можно подразделить на два класса: инсерционное редактирование и редактирование с замещением. В первом случае редактирование мРНК сопровождается вставкой и/или удалением специфических нуклеотидов. Предполагается, что при такой форме редактирования последовательность нуклеотидов мРНК образует гибрид с gРНК, что сопровождается появлением неспаренных и ошибочно спаренных оснований, которые и маркируют сайты редактирования. Далее происходит расщепление углевод-фосфатного остова мРНК по этим сайтам в результате реакции трансэтерификации между фосфатными группами мРНК и встраиваемых нуклеотидов с последующим повторным лигированием образовавшихся фрагментов мРНК, сопровождаемым вставкой или удалением нуклеотидов. Такой механизм реализуется, по крайней мере, в митохондриях некоторых жгутиковых, а также слизневиков. У последних в результате редактирования митохондриальных мРНК имеют место вставки остатков С. Инсерционное редактирование мРНК парамиксовирусов, сопровождающееся вставками остатков G, по-видимому, происходит вследствие ошибок РНК-полимеразы при транскрипции соответствующих генов. В результате редактирования с замещением, как это имеет место в случае редактирования ApoB-мРНК, а также, возможно, мРНК митохондрий и хлоропластов высших растений и ионных каналов, не происходит расщепления фосфодиэфирных связей в редактируемой РНК, а новое азотистое основание синтезируется in situ (т.е. модифицируется непосредственно в ее полинуклеотидной цепи). При этом не используется gРНК. Формально такой механизм напоминает реакции посттранскрипционной модификации азотистых оснований в тРНК, рРНК, малых ядерных РНК, а также двухцепочечных РНК.
Каково же биологическое значение механизма редактирования генетической информации на уровне мРНК? Какие силы заставили этот механизм эволюционно закрепиться у большого числа далеко отстоящих друг от друга биологических видов? Почему для организмов выгоднее изменять информацию посттранскрипционно, а не заключать ее непосредственно в генах? Очевидно, что для этого должны быть веские, не вполне понятные сегодня причины, которые не допускают перехода к обычному кодированию такой информации. На мой взгляд, редактирование мРНК может иметь непосредственное отношение к дополнительной стабилизации генетической информации в наиболее уязвимых для мутагенеза генетических локусах. Действительно, редактирование РНК получило наибольшее распространение в хлоропластах и митохондриях высших организмов, а также у одноклеточных эукариот. В разделе 5.3.1 приводится обоснование того, что дополнительная защита генетической информации от разрушительного действия химических мутагенов особенно нужна именно многоклеточным организмам для предотвращения накопления генетического груза в делящихся соматических клетках при онтогенезе. Вероятно, одним из путей достижения этого было эволюционное включение в геном эукариот избыточных последовательностей нуклеотидов. У свободноживущих одноклеточных организмов на популяционном уровне такой проблемы не существует, поскольку гибель отдельной свободноживущей клетки не грозит существованию популяции этих клеток, как это имеет место у Metazoa. Однако у митохондрий и хлоропластов, часто рассматриваемых в качестве внутриклеточных микроорганизмов-эндосимбионтов, наблюдаются совершенно особые условия существования. Несмотря на то что их геном содержит мало избыточных последовательностей и, следовательно, слабо защищен ими от химических мутагенов, мутации в определенных генах митохондрий и хлоропластов могут быть летальными для соматической клетки-хозяина и всего многоклеточного организма. В этих условиях мутационное изменение нуклеотидов, подвергающихся редактированию на уровне РНК, фактически заменяет само редактирование, и такие мутации нейтральны в функциональном отношении. В отсутствие мутаций редактирование корректирует первичную структуру РНК, а при наличии их необходимость в редактировании отпадает. Иными словами, во всех этих локусах редактирование как бы упреждает мутационные замены редактируемых нуклеотидов в генах, которые геном по каким-то причинам не может эффективно предотвратить в силу особенностей структуры и функционирования соответствующих генетических локусов. По аналогии с неоднозначностью генетического кода наличие механизма редактирования допускает сосуществование в конкретных генетических локусах " вырожденных сайтов", различающихся по первичной структуре, но не своему генетическому смыслу.
|
|
