
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Равновесие электролитической диссоциации в растворе
|
|
Диссоциация слабых электролитов подчиняется закону действующих масс и может быть количественно охарактеризована константой равновесия (при постоянных условиях не изменяющиеся во времени).
Например, в системе вода– уксусная кислота устанавливается равновесие:
CH3COOH↔ H++CH3COO-
Число молекул, распавшихся в единицу времени, равно числу молекул, образовавшихся за счет соединения ионов Н+ и CH3COO-.
Константа равновесия реакции диссоциации – это есть константа диссоциации (Кд). Например, выражение для Кд уксусной кислоты имеет вид:

 (1)
(1)
где [Н +] и [CH3COO-] —равновесные концентрации соответствующих ионов, моль/л; [СНзСООН] — равновесная концентрация недиссоциированных молекул кислоты, моль/л.
Константы диссоциации, выражаемые уравнениями (1), называют классическими (или концентрационными) константами и обозначают Кс (в отличие от термодинамических констант, которые обозначают Ка).


Как видно, степень диссоциации возрастает обратно пропорционально корню квадратному из концентрации электролита. Например, при уменьшении концентрации в 100 раз степень диссоциации возрастает в 10 раз.
Таким образом, степень диссоциации электролита зависит:
- от концентрации,
- от природы растворителя,
- электролита и температуры.
Аналогично, в системе Н2О — NH4OH устанавливается равновесие:

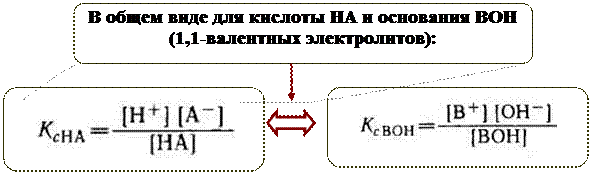
.
Для расчетов, связанных с диссоциацией кислот, часто удобно пользоваться не константой Кс, а так называемым показателем константы диссоциации рК, который определяется соотношением: 
|
|
