
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Квантовые числа
|
|
Состояние электрона в атоме описывается значениями 4-х квантовых чисел.
Главное квантовое число (n) характеризует энергетические состояния или уровни на которых может находиться электрон. С увеличением n возрастает размер электронного облака и увеличивается энергия электрона. n может принимать только положительные целые значения 1, 2, 3, …¥.
Max число орбиталей на уровне = n2;
Max число электронов на уровне = 2n2;
Значениям главных квантовых чисел соответствует буквенное обозначение квантовых слоев:
| n= | 1, 2, 3, 4, 5, 6, 7 |
| обозначение квантовых слоев | K, L, M, N, O, P, Q |
Орбитальное квантовое число ( ) характеризует форму электронного облака и принимает значения от 0 до n-1:
) характеризует форму электронного облака и принимает значения от 0 до n-1:
 = 0, 1, 2, 3… n-1. При n= 3
= 0, 1, 2, 3… n-1. При n= 3  = 0, 1, 2. Орбитальное квантовое число
= 0, 1, 2. Орбитальное квантовое число  обычно обозначают латинскими буквами:
обычно обозначают латинскими буквами:
 … …
| 0 1 2 3 4 |
| Обозначение | s p d f g |
Состояния электрона, характеризующиеся различными значениями  , принято называть также энергетическими подуровнями.
, принято называть также энергетическими подуровнями.
Решение вероятностного волнового уравнения для электрона с  = 0 показывает, что они с большой вероятностью находятся в сфере. Эта сферическая орбиталь с
= 0 показывает, что они с большой вероятностью находятся в сфере. Эта сферическая орбиталь с  = 0 называется s- орбиталью. При
= 0 называется s- орбиталью. При  =1 зона вероятностного расположения электрона представляет собой гантелеобразное облако с центром в ядре (p-орбиталь), у d-орбитали (
=1 зона вероятностного расположения электрона представляет собой гантелеобразное облако с центром в ядре (p-орбиталь), у d-орбитали ( =2) – форма розетки, у f-орбитали – более сложная форма.
=2) – форма розетки, у f-орбитали – более сложная форма.
Max число орбиталей на подуровне = 2  +1;
+1;
Max число электронов на подуровне = 2(2  +1).
+1).
Магнитное квантовое число (m  )
)
Квантовое число называется магнитным, поскольку учитывает влияние магнитного и электрического полей на состояние электрона, ведь электрон может различным образом ориентироваться в пространстве. Магнитное квантовое число характеризует расположение и число возможных ориентаций орбиталей. Оно может принимать целочисленные значения от -  до +
до +  : m
: m  = 0; ±1; ±2; ±
= 0; ±1; ±2; ±  . В зависимости от значений m
. В зависимости от значений m  определяются возможные ориентации одной и той же формы орбиталей и их число, которое равно количеству значений m
определяются возможные ориентации одной и той же формы орбиталей и их число, которое равно количеству значений m  . Так, для s-орбиталей с
. Так, для s-орбиталей с  =0 m
=0 m  =0, т.е. одна ориентация поскольку шар симметричен относительно 3-х осей ординат. Для p-орбиталей с
=0, т.е. одна ориентация поскольку шар симметричен относительно 3-х осей ординат. Для p-орбиталей с  =1, m
=1, m  =-1; 0; 1, что соответствует трем ориентациям p-орбитали относительно трех осей ординат, поэтому они обозначаются соответствующими индексами px, py, pz.
=-1; 0; 1, что соответствует трем ориентациям p-орбитали относительно трех осей ординат, поэтому они обозначаются соответствующими индексами px, py, pz.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Для d- орбиталей с  =2 число возможных ориентаций –5: -2; -1; 0; 1; 2. (рис.1.)
=2 число возможных ориентаций –5: -2; -1; 0; 1; 2. (рис.1.)
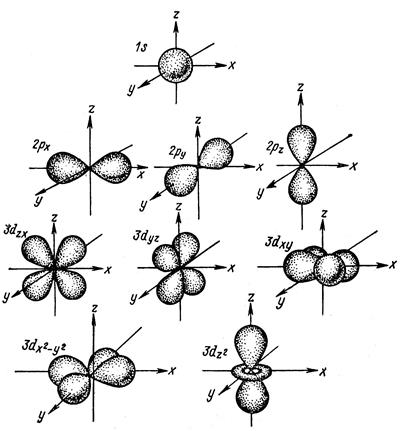
Рис.1. Формы и пространственная ориентация электронных облаков 1s-, 2p-, 3d- электронов
Спиновое квантовое число (ms) характеризует наличие у электрона еще одной степени свободы. Упрощенно можно это представить как возможность вращения электрона вокруг собственной оси. Возможны два значения спинового квантового числа  ;
; 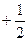 .
.
|
|
