
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Физические свойства. Низшие кислоты с числом атомов углерода до 3 – легколетучие бесцветные жидкости с характерным острым запахом
|
|
Низшие кислоты с числом атомов углерода до 3 – легколетучие бесцветные жидкости с характерным острым запахом, смешиваются с водой в любых соотношениях. Большинство кислот С4 – С9 – маслянистые жидкости с неприятным запахом. Растворимость в воде сильно уменьшается с ростом молекулярной массы. Кислоты от С10 и выше – твердые вещества, нерастворимые в воде. Плотности муравьиной и уксусной кислот больше единицы, остальных – меньше единицы. Температура кипения возрастает с увеличением молекулярной массы, при одном и том же числе углеродных атомов кислоты нормального строения кипят выше, чем кислоты с разветвленным углеродным скелетом. Сравнение температур кипения кислот и спиртов с одинаковым числом углеродных атомов показало, что кислоты кипят при значительно более высоких температурах, чем спирты. Это свидетельствует о более высокой ассоциации молекул кислот по сравнению со спиртами за счет образования водородных связей.
Карбоновые кислоты, как и спирты, способны образовывать водородные связи. Если акцептором является достаточно сильное основание, образование водородной связи предшествует полному переносу протона к основанию. По Бренстеду соединение – донор водорода считают «кислотой». Будет ли данное соединение «донором водорода» («кислотой»), зависит от природы «акцептора водорода» («основания»). Чем сильнее основание, тем больше вероятность того, что данное соединение будет вести себя по отношению к нему как кислота:
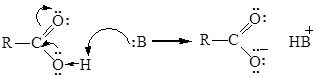
Межмолекулярные водородные связи, возникающие между молекулами карбоновых кислот, настолько прочны, что даже в газообразном состоянии значительная часть молекул существует в виде димеров:
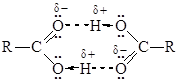
С ростом углеводородной цепи способность кислот к образованию водородных связей уменьшается.
Лекция 21. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
Строение карбоксильной группы. Кислотные свойства, константа кислотности, влияние на нее структурных и электронных факторов.Реакции со щелочами и карбонатами, металлами. Карбоксилат-анионы. Реакции замещения гидроксильной группы: взаимодействие схлоридами фосфора и тионилхлоридом. Механизм реакции этерификации. Кислотный катализ.
Группы С=О и О-Н, образующие карбоксильную группу, взаимно влияют друг на друга и проявляют иные свойства, чем в карбонильных соединениях и спиртах.
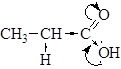
Карбоновые кислоты имеют три реакционных центра, в соответствии с этим все реакции карбоновых кислот можно разделить на три типа:
- протекающие с разрывом связи О-Н
- протекающие с разрывом связи С-О
- протекающие с разрывом связи С-Н
|
|
