
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Диссоциация карбоновых кислот
|
|
Карбоновые кислоты обладают более выраженными кислотными свойствами, чем спирты, из-за стабилизации карбоксилат – аниона, вызванной делокализацией p-электронов. Другими словами, карбоксилат-ион стабилизирован вследствие резонанса:
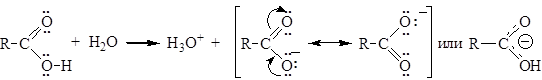
Степень делокализации изменяется в ряду RCОО- > > RCOОH > > RОH, RO-
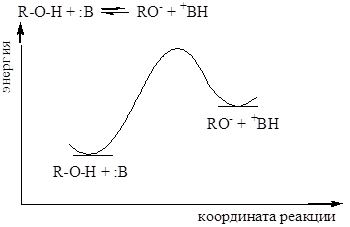

Энергия а - стабилизация, вызванная делокализацией в RCOOH; b - стабилизация, обусловленная делокализацией в RCOО-; 1 - гипотетическая кривая, делокализация отсутствует; 2 - истинная кривая, имеется делокализация.
Кислотность выражают количественно через константу диссоциации Ка или через рКа. Константы диссоциации большинства карбоновых кислот составляют около 10-5 (например, для уксусной кислоты 1, 8∙ 10-5), что свидетельствует о довольно высокой концентрации неионизированной формы кислоты. Поэтому большая часть карбоновых кислот относится к слабым кислотам. Кислотность больше для тех кислот, в молекуле которых имеется заместитель, стабилизирующий карбоксилат-анион. Электроноакцепторные заместители в молекуле карбоновой кислоты, оттягивающие электроны от карбоксильной группы, стабилизируют карбоксилат-ион и увеличивают способность его образования, т.е. увеличивают силу кислоты. Электронодонорные заместители оказывают противоположное действие.
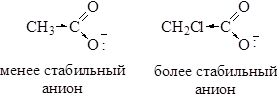
Влияние заместителей на кислотность показано в таблице 21.1.
Таблица 21.1
Влияние заместителей на кислотность
| Кислота | рКа |
| СН3СООН | 4.8 |
| СН3СН2СООН | 4.8 |
| ClСН2СООН | 2.9 |
| Cl2СНСООН | 1.3 |
| Сl3CСООН | 0.7 |
| FСН2СООН | 2.6 |
| F3CСООН | 0.2 |
2.Образование солей. Органические кислоты образуют соли с металлами, их оксидами, карбонатами, гидрокарбонатами и щелочами, например:
СН3СООН + NaOH ® СН3СОО-Na+ + H2O
3.Образование галогенангидридов. Под действием галогенидов фосфора (PCl5, PCl3, PBr3) карбоновые кислоты образуют галогенангидриды (гидроксил замещается на галоген):
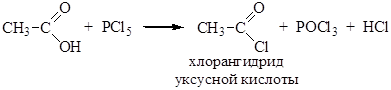
Хлорангидриды могут также быть получены действием на карбоновые кислоты тионилхлорида:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
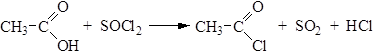
4. Реакция с аммиаком. При комнатной температуре карбоновые кислоты образуют с аммиаком аммонийные соли, которые при нагревании превращаются в амиды карбоновых кислот:
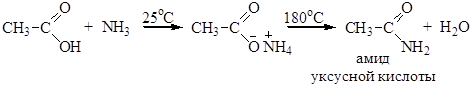
|
|
