
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Пример 5.
|
|
Для газофазной реакции А + В = D + F рассчитайте константу равновесия при температуре Т = 700 К и равновесные концентрации веществ в системе, если известно, что стандартное изменение энергии Гиббса реакции при этой температуре равно D r G 0 = - 8 кДж и начальные концентрации равны:
С 0, А = 2 моль/л, С 0, В = 3 моль/л. Концентрации веществ D и F в начальный момент равны нулю. 
Решение. Стандартная константа равновесия K 0 связана со стандартной энергией Гиббса реакции по уравнению: D r G 0 = - RT ln K 0.
Отсюда находим логарифм стандартной константы равновесия:
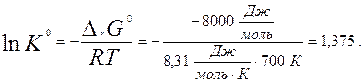
Следовательно, K 0 = e 1, 375 = 3, 96.
Стандартная константа равновесия выражается через относительные равновесные парциальные давления участников реакции, возведенных в степени, равные стехиометрическим коэффициентам. В данном случае:
 где
где 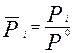 - относительное равновесное парциальное давление i – го компонента, P i - его равновесное парциальное давление,
- относительное равновесное парциальное давление i – го компонента, P i - его равновесное парциальное давление,
P 0 – стандартное давление. Так как нам надо рассчитать равновесные концентрации, то расчет необходимо вести через константу равновесия K C, выраженную через равновесные концентрации участников реакции. В данном случае она равна: 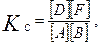 где квадратными скобками обозначены равновесные концентрации соответствующих веществ. Константы равновесия K 0 и K C связаны между собой следующим соотношением:
где квадратными скобками обозначены равновесные концентрации соответствующих веществ. Константы равновесия K 0 и K C связаны между собой следующим соотношением: 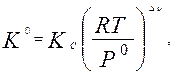
где Dn - изменение числа молей газообразных участников реакции. Для данной реакции Dn = n D + n F – n A- nB= 1 + 1 – 1 – 1 = 0. Следовательно, константы равновесия равны K 0 = K C.
Теперь проведем расчет равновесных концентраций участников реакции. Предположим, что к моменту равновесия прореагировало x моль /л вещества А, тогда из уравнения реакции следует, что в реакцию вступило x моль /л вещества В и образовалось x моль /л вещества D и x моль /л вещества F. Выражаем через x равновесные концентрации веществ:
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
| Вещество | Начальная концентрация, моль/л | Равновесная концентрация, моль/л |
| A | 2 - x | |
| B | 3 - x | |
| D | x | |
| F | x |
Подставим равновесные концентрации в выражение для константы равновесия
K C и получим: 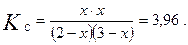
Решаем это уравнение относительно x. Оно преобразуется к следующему квадратному уравнению: 2, 96 x 2 – 19, 80 x + 23, 76 = 0.
По известным формулам для квадратного уравнения находим, что это уравнение имеет два корня: x 1 = 5, 12 и x 2 = 1, 57. Корень x 1 не удовлетворяет условию задачи, так как начальные количества исходных веществ меньше. Условию задачи удовлетворяет корень x 2 = 1, 57. Следовательно, равновесные концентрации веществ равны: [A] = 2 – 1, 57 = 0, 43 моль/л; [B] = 3 – 1, 57 = 1, 43 моль/л;
[D] = [F] = 1, 57 моль/л.
Раздел «Химическая кинетика»
Пример 1. Определите время, за которое прореагирует 90 % вещества А, разлагающегося по реакции первого порядка: A ® B + D, если известно, что время полупревращения составляет t ½ = 40 мин.
Решение. Текущая концентрация исходного вещества для реакции 1 – го порядка определяется уравнением: C = C0 exp (-kt) (1)
Количество распавшегося вещества А к моменту времени t равно x = C0 - C
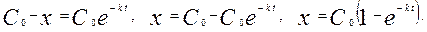 |
Подставим в уравнение (1) С = С 0 - x и получим
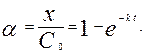 |
Доля распавшегося вещества a равна
Из этого уравнения выразим экспоненту: 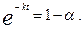
Логарифмируем это выражение и находим время:
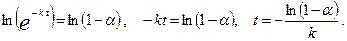
Константу скорости реакции находим из уравнения для периода полупревращения реакции первого порядка: 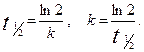
Подставляем выражение для k в уравнение для времени t и получаем окончательное уравнение: 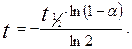

 Проводим вычисления:
Проводим вычисления:
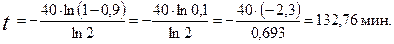
Пример 2. Для элементарной реакции A + B = D + F при начальных концентрациях реагентов С А 0 = С В 0 = 0, 6 моль/л через 20 мин. после начала реакции концентрация вещества А уменьшилась до значения С А 1 = 0, 4 моль/л. Определите концентрацию вещества А через 60 мин. после начала реакции.
Решение. Поскольку данная реакция элементарная, то это реакция второго порядка. При равных начальных концентрациях реагентов для реакции второго порядка решение дифференциального уравнения
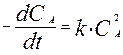
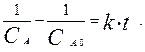 |
приводит к следующему результату:
Выразим из этого уравнения константу скорости и текущую концентрацию

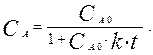
Вычислим константу скорости по заданным условиям:
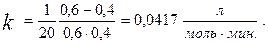
Далее вычисляем концентрацию вещества А через 60 мин. после начала реакции: 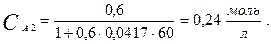
Пример 3. Скорость образования NО в реакции: NOBr(г) ® NO(г) +1/2 Br2 (г)
равна 1, 6× 10 -4 моль/(л× с). Определите скорость реакции, скорость расходования NOBr и скорость образования Br2 .
— Разгрузит мастера, специалиста или компанию;
— Позволит гибко управлять расписанием и загрузкой;
— Разошлет оповещения о новых услугах или акциях;
— Позволит принять оплату на карту/кошелек/счет;
— Позволит записываться на групповые и персональные посещения;
— Поможет получить от клиента отзывы о визите к вам;
— Включает в себя сервис чаевых.
Для новых пользователей первый месяц бесплатно. Зарегистрироваться в сервисе
Решение. Из уравнения следует, что из 1 моль NOBr2 образуется 1 моль NO и 1/2 моль Br2, тогда скорость реакции можно выразить через изменение концентрации любого компонента:
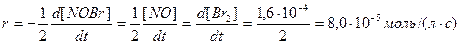
Скорость расходования NOBr равна скорости образования NO с обратным знаком, а скорость образования Br2 в 2 раза меньше скорости образования NO:
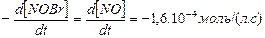 ,
, 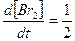
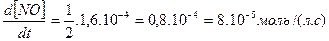
 | |||||||||
|
|
