
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
Второй закон термодинамики
|
|
В задачах (428-443) определите энтропию 1 моль газа при давлении P и стандартной температуре. Укажите, увеличивается или уменьшается энтропия вещества при изменении давления от стандартного к заданному. Значения энтропии при стандартных условиях возьмите из приложения, примите, что данные вещества подчиняются законам идеального газа.
| № п/п | Газ | P× 10-5, Па | № п/п | Газ | P× 10-5, Па |
| H2 | 3, 039 | C2H4 | 0, 601 | ||
| H2O | 10, 130 | N2 | 0, 507 | ||
| He | 1, 519 | O2 | 0, 840 | ||
| CH4 | 8, 100 | F2 | 1, 722 | ||
| CO | 0.405 | Cl2 | 1, 925 | ||
| NO | 1, 823 | Ne | 3, 039 | ||
| CO2 | 1, 317 | Ar | 2, 533 | ||
| C2H6 | 0, 709 | Kr | 1, 013 |
В задачах (444-461) рассчитайте энтропию 1 моль вещества в двухкомпонентном растворе при известной массовой доле ω, полагая, что раствор является идеальным.
| № п/п | Вещество | ω, % | Растворитель | № п/п | Вещество | ω, % | Растворитель |
| C | 0, 36 | Fe | Cu | 5, 8 | Sn | ||
| Al | 13, 5 | Cu | Mn | 1, 3 | Cu | ||
| Sn | 4, 5 | Cu | Co | 10, 5 | W | ||
| Cr | Ni | Fe | 3, 1 | Ni | |||
| Zn | 3, 8 | Cu | Ni | 5, 2 | Cu | ||
| Be | 2, 7 | Cu | Sb | 15, 7 | Pb | ||
| Si | 13, 9 | Fe | Rh | 10, 0 | Pt | ||
| Si | 17, 5 | Al | Ir | 15, 9 | Pt | ||
| Al | 1, 8 | Ni | Ag | 12, 5 | Au |
В задачах (462-480) рассчитайте энтропию каждого компонента в газовой смеси, подчиняющейся законам идеальных газов, и энтропию смеси.
| № п/п | 1-й компонент | 2-й компонент | 3-й компонент | |||
| Символ | n 1, моль | Символ | n 2, моль | Символ | n 3, моль | |
| H2 | 1, 0 | N2 | 2, 0 | Ar | 5, 0 | |
| He | 1, 5 | H2 | 2, 5 | N2 | 4, 0 | |
| N2 | 2, 0 | Ne | 3, 0 | Kr | 3, 0 | |
| Ar | 3, 5 | He | 2, 0 | H2 | 2, 5 | |
| Ne | 2, 0 | N2 | 1, 5 | O2 | 3, 5 | |
| O2 | 1, 5 | Ne | 1, 0 | Ar | 2, 5 | |
| H2 | 2, 0 | N2 | 3, 0 | Ar | 4, 0 | |
| O2 | 1, 0 | F2 | 2, 5 | N2 | 4, 5 | |
| He | 2, 0 | Cl2 | 3, 0 | Ne | 1, 5 | |
| Ne | 2, 5 | H2 | 2, 0 | O2 | 3, 5 | |
| N2 | 3, 0 | Kr | 2, 0 | Ne | 2, 0 | |
| O2 | 2, 0 | He | 1, 5 | F2 | 3, 5 | |
| H2 | 1, 0 | Ne | 3, 0 | N2 | 5, 0 | |
| Kr | 0, 5 | F2 | 2, 5 | He | 2, 5 | |
| Ar | 2, 0 | H2 | 1, 0 | Ne | 1, 5 | |
| N2 | 3, 5 | F2 | 1, 5 | Kr | 2, 0 | |
| Ne | 1, 5 | He | 2, 5 | H2 | 3, 5 | |
| O2 | 2, 0 | N2 | 2, 0 | Ar | 4, 0 | |
| H2 | 1, 0 | N2 | 3, 0 | He | 2, 0 |
В задачах (481-505) рассчитайте стандартное изменение энергии Гиббса D r G T 0 и константу равновесия K 0 при заданной температуре T. Укажите, в каком направлении протекает реакция при данной температуре и направление смещения равновесия при увеличении температуры. При обосновании направления смещения равновесия используйте уравнение изобары химической реакции.
| № п/п | Уравнение реакции | Т, К |
| 2H2(г) + CO(г) ó CH3OH(ж) | ||
| 4HCl(г) + O2(г) ó 2H2O(г) + 2Cl2(г) | ||
| 2N2(г) + 6H2O(г) ó 4NH3(г) + 3O2(г) | ||
| 4NO(г) + 6H2O(г) ó 4NH3(г) + 5O2(г) | ||
| 2NO2(г) ó 2NO(г) + O2(г) | ||
| N2O4(г) ó 2NO2(г) | ||
| S2(г) + 4H2O(г) ó 2SO2(г) + 4H2(г) | ||
| S2(г) + 4CO2(г) ó 2SO2(г) + 4CO(г) | ||
| 2SO2(г) + O2(г) ó 2SO3(г) | ||
| CO2(г) + H2(г) ó CO(г) + H2O(г) | ||
| SO2(г) + Cl2(г) ó SO2Cl2(г) | ||
| CO(г) + 3H2(г) ó CH4(г) + H2O(г) | ||
| 4CO(г) + SO2(г) ó S2(г) + 4CO2(г) | ||
| C2H5OH(г) ó C2H4(г) + H2O(г) | ||
| FeO(k) + CO(г) ó Fe(k) + CO2(г) | ||
| WO3(k) + 3H2(г) ó W(k) + 2H2O(г) | ||
| NH4Cl(k) ó NH3 + HCl | ||
| Mg(OH)2(k) ó MgO(k) + H2O(г) | ||
| H2O(г) + C(графит) ó CO(г) + H2(г) | ||
| PbO2(к) + C(графит) ó Pb(к)+ CO2(г) | ||
| MnO2(k) + 2H2 ó Mn(k) + 2H2O(г) | ||
| 3Fe(к)+ 4H2O(г) ó Fe3O4(к) + 4H2(г) | ||
| C6H6(г) + 3H2(г) ó C6H12(г) | ||
| NiOH2(k) ó NiO(k) + H2O(г) | ||
| 2CrCl3(k) ó 2CrCl2(k) + Cl2(г) |
В задачах (506-513) для газофазной реакции А + В = С +D рассчитайте константу равновесия при температуре Т и равновесный состав системы при этой температуре, если известны D r G 0 T и начальные концентрации исходных веществ С 0. Концентрация продуктов реакции в начальный момент равна нулю.
| № п/п | Т, К | D r G 0 T, кДж/моль | С 0, моль/л | № п/п | Т, К | D r G 0 T, кДж/моль | С 0, моль/л | ||
| А | В | А | В | ||||||
| - 14, 1 | - 1, 6 | ||||||||
| - 13, 8 | - 3, 6 | ||||||||
| - 7, 5 | - 5, 7 | ||||||||
| - 6, 7 | - 10, 1 | ||||||||
| - 6, 0 | - 9, 2 | ||||||||
| - 20, 5 | - 8, 5 | ||||||||
| - 25, 4 | -18, 5 | ||||||||
| - 28, 5 | - 4, 6 |
В задачах (522-536) для данной гомогенной реакции А + В Û С +D определите температуру, при которой наступает равновесие. Температурной зависимостью D r H 0 и D r S 0 можно пренебречь. Рассчитайте равновесный состав системы при этой температуре, если известны начальные концентрации исходных веществ C0 (продукты реакции в начальный момент времени отсутствуют).
| № п/п | Уравнение реакции | С 0, моль/л | |
| А | В | ||
| CO (г) + Cl 2 (г) = COCl2 (г) | |||
| CO (г) + ½ O 2 (г) = CO 2 (г) | 0, 5 | ||
| NO (г) + ½ O 2 (г) = NO 2 (г) | 0, 5 | ||
| CH 4 (г) + CO 2 (г) = 2 CO (г) + 2 H 2 (г) | |||
| CCl4 (г) + H2O (г) = COCl 2(г) +2 HCl (г) | |||
| CO (г) + 2 H 2(г) = CH 3 OH (г) | 0, 5 | ||
| SO 2 (г) + Cl 2(г) = SO 2 Cl 2(г) | 0, 5 | 0, 5 | |
| C 2 H 2(г) + N 2(г) = 2 HCN(г) | |||
| C 2 H 6(г) = C 2 H 4 (г) + H 2(г) | - | ||
| CO (г) + NO (г) = CO 2 (г) + ½ N 2 (г) | 0, 5 | 0, 5 | |
| CH 4(г) + CH3Cl(г) = C2 H6(г) + HCl(г) | |||
| PCl 5(г) = PCl 3(г) + Cl 2(г) | 0, 5 | - | |
| CO 2 (г) + H 2 (г) = HCOOH (г) | 0, 2 | 0, 2 | |
| CF2Cl 2 (г) = C 2 F 4 (г) + 2 Cl 2 (г) | - | ||
| 2 CH 4 (г) = C 2 H 2 (г) + H 2 (г) | 0, 5 | - |
В задачах (537-556), используя уравнение температурной зависимости константы равновесия 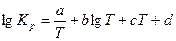 , рассчитайте константу равновесия К р при стандартной температуре Т 1 = 298К и при заданной температуре Т 2. Укажите, в каком направлении смещается равновесие реакции при повышении температуры. Рассчитайте константу равновесия Кс при стандартной температуре.
, рассчитайте константу равновесия К р при стандартной температуре Т 1 = 298К и при заданной температуре Т 2. Укажите, в каком направлении смещается равновесие реакции при повышении температуры. Рассчитайте константу равновесия Кс при стандартной температуре.
— Регулярная проверка качества ссылок по более чем 100 показателям и ежедневный пересчет показателей качества проекта.
— Все известные форматы ссылок: арендные ссылки, вечные ссылки, публикации (упоминания, мнения, отзывы, статьи, пресс-релизы).
— SeoHammer покажет, где рост или падение, а также запросы, на которые нужно обратить внимание.
SeoHammer еще предоставляет технологию Буст, она ускоряет продвижение в десятки раз, а первые результаты появляются уже в течение первых 7 дней. Зарегистрироваться и Начать продвижение
| № п/п | Реакция | T 2, K | a | b | c | d |
| 2H2 + CO «CH3OH | -9, 13 | 30, 8 · 10-4 | 3, 401 | |||
| 4HCl + O2 «2H2O + 2Cl2 | -2, 13 | -8, 57 · 10-4 | -4, 710 | |||
| b-NH4Cl(к) «NH3(г) + HCl(г) | -9650 | 1, 83 | -32, 4 · 10-4 | 28, 239 | ||
| 2N2 + 6H2O «4NH3 + 3O2 | -66250 | -1, 75 | -10, 206 | |||
| 4NO + 6H2O «4NH3 + 5O2 | -47500 | -1, 75 | -13, 706 | |||
| 2NO2 «2NO + O2 | -5749 | 1, 75 | -5, 0 · 10-4 | 7, 899 | ||
| N2O4 «2NO2 | -2692 | 1, 75 | -4, 8 · 10-4 | 1, 944 | ||
| Mg(OH)2 «MgO + O2 | -4600 | 0, 623 | -10, 0 · 10-4 | 17, 776 | ||
| CaCO2 «CaO + CO2 | -9680 | -1, 38 | -2, 19 · 10-4 | 17, 756 | ||
| Ca(OH)2 «CaO +CO2 | -5650 | 0, 67 | 4, 14 · 10-4 | 9, 616 | ||
| S2 + 4H2O «2SO2 + 4H2 | -13800 | -0, 88 | 26, 7 · 10-4 | 8, 386 | ||
| S2 + 4CO2 «2SO2 + 4CO | -23000 | 4, 34 | -16, 2 · 10-4 | 2, 576 | ||
| 2SO2 + O2 «2SO3 | 1, 222 | -18, 806 | ||||
| SO2 + Cl2 «SO2Cl2 | -1, 75 | 4, 55 · 10-4 | -7, 206 | |||
| CO + 3H2 «CH4 + H2O | -7, 14 | 18, 8 · 10-4 | -1, 371 | |||
| 4CO + 2SO2 «S2 + 4CO2 | -4, 34 | -2, 576 | ||||
| COCl2 «CO + Cl2 | 1, 75 | 3, 748 | ||||
| CO2 + H2 «CO + H2O | -2203 | -0, 52 · 10-4 | 2, 300 | |||
| CO2 + 4H2 «CH4 + 2H2O | -6, 23 | 9, 06 · 10-4 | -1, 291 | |||
| 2CO2 «2CO +O2 | 1, 75 | -12, 15 · 10-4 | 3, 290 |
В задачах (557-580) определите, при какой температуре в системе устанавливается химическое равновесие, укажите, используя уравнение изобары химической реакции, в каком направлении протекает реакция при температуре, отличающейся от равновесной в большую или меньшую сторону
| № п/п | Уравнение реакции |
| CH4 (г) + CO2 (г) ó CH3COOH (ж) | |
| 2H2 (г) + CO2 (г)ó HCOH (ж) + H2O (ж) | |
| CO2 (г) + H2 (г) ó HCOOH (ж) | |
| 2SO2 (г) + O2 (г) ó 2SO3 (г) | |
| CO (г) + 2H2 (г) ó CH3OH (г) | |
| Ca(OH)2 (к) ó CaO (к) + H2O (г) | |
| CaCO3 (к) ó CaO (к) + CO2 (г) | |
| NH4Cl (к) ó NH3 (г) + HCl (г) | |
| H2 (г) + Cl2 (г) ó 2HCl (г) | |
| O2 (г) ó 2O (г) | |
| CO2 (г) + H2 (г) ó CO (г) +H2O (г) | |
| 2CO (г) + O2 (г) ó 2CO2 (г) | |
| 2H2 (г) + O2 (г) ó 2H2O (г) | |
| N2 (г) ó 2N (г) | |
| 2NO (г) ó N2 (г) + O2 (г) | |
| CH4 (г) + H2O (г) ó CO (г) + 3H2 (г) | |
| CH4 (г) + CO2 (г) ó 2CO (г) + 2H2 (г) | |
| 2CH4 (г) ó C2H2 (г) + 3H2 (г) | |
| F2 (г) ó 2F(г) | |
| Cl2 (г) ó 2Cl (г) | |
| HCl (г) ó H (г) + Cl (г) | |
| HF (г) ó H (г) + F (г) | |
| 2HCl (г) + F2 (г) ó 2HF (г) + Cl2 (г) | |
| C2H6 (г) ó C2H2 (г) + 2H2 (г) |
|
|
