
Главная страница Случайная страница
Разделы сайта
АвтомобилиАстрономияБиологияГеографияДом и садДругие языкиДругоеИнформатикаИсторияКультураЛитератураЛогикаМатематикаМедицинаМеталлургияМеханикаОбразованиеОхрана трудаПедагогикаПолитикаПравоПсихологияРелигияРиторикаСоциологияСпортСтроительствоТехнологияТуризмФизикаФилософияФинансыХимияЧерчениеЭкологияЭкономикаЭлектроника
⚡️ Для новых пользователей первый месяц бесплатно. А далее 290 руб/мес, это в 3 раза дешевле аналогов. За эту цену доступен весь функционал: напоминание о визитах, чаевые, предоплаты, общение с клиентами, переносы записей и так далее.
✅ Уйма гибких настроек, которые помогут вам зарабатывать больше и забыть про чувство «что-то мне нужно было сделать».
Сомневаетесь? нажмите на текст, запустите чат-бота и убедитесь во всем сами!
Смещение химического равновесия.
|
|
В целях более полного превращения исходных веществ в продукты, возникает необходимость смещения равновесия в сторону прямой реакции. Этого можно достигнуть путем изменения условий протекания реакции. Изменяя условия (концентрацию, температуру, а для газов ещё и давление), можно перевести систему из одного равновесного состояния в другое, отвечающее новым условиям.
Химическое равновесие смещается потому, что изменение условий неодинаково влияет на скорости прямой и обратной реакций. Через некоторое время эти скорости вновь сравниваются, и наступает состояние равновесия, отвечающее новым условиям. Изменение равновесных концентраций реагирующих веществ, вызванное изменением какого-либо условия, называется смещением, или сдвигом равновесия.
Если при изменении условий увеличилась концентрация образующихся веществ, т.е. веществ, формулы которых находятся в правой части уравнения, то говорят о смещении равновесия вправо. Если изменение условий влечёт за собой увеличение концентраций исходных веществ, формулы которых стоят в левой части уравнения, то это рассматривают как смещение равновесия влево.
Смещение химического равновесия с изменением условий подчиняется правилу, известному под названием принципа Ле Шателье - Брауна:
Если на химическую реакцию, которая находится в состоянии химического равновесия, произвести какое-либо воздействие (изменить температуру, давление, концентрации веществ), то увеличится скорость той реакции (прямой или обратной), протекание которой приведет к ослаблению данного воздействия.
Следует отметить, что принцип Ле Шателье-Брауна приложим не только к химическим реакциям, но и ко многим процессам, не имеющим чисто химического характера: испарение, конденсация, плавление, кристаллизация и др.
Влияние изменения температуры на смещение химического равновесия. Определяется знаком теплового эффекта. Его можно найти экспериментально или рассчитать на основе закона Гесса. Чем он больше, тем сильнее влияние температуры. Если же он близок к нулю, то изменение температуры практически не влияет на равновесие.
Согласно принципу Ле Шателье-Брауна при повышении температуры происходит смещение равновесия в сторону эндотермической реакции (т.е. её скорость увеличивается). При понижении температуры равновесие смещается в направлении экзотермической реакции, идущей с выделением тепла (т.е. её скорость увеличивается).

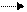 Н-р, в случае процесса N2O4 2NO2 – 56, 84 кДж
Н-р, в случае процесса N2O4 2NO2 – 56, 84 кДж
прямая реакция протекает с поглощением тепла и является эндотермической; обратная реакция протекает с выделением тепла и является экзотермической. Повышение температуры приведет к увеличению скорости эндотермической реакции и равновесие сместится вправо, т.е. разложение N2O4 будет ускоряться (Vпрям.↑, Vобр.↓). Понижение температуры приведет к увеличению скорости экзотермической реакции и равновесие сместится влево, т.е. будет ускоряться образование N2O4 (Vпрям.↓, Vобр.↑).
Влияние изменения концентрации (парциального давления) на смещение химического равновесия. Введение в равновесную систему (реакцию) дополнительных количеств любого из реагирующих веществ ускоряет ту реакцию, при которой оно расходуется. Таким образом, увеличение концентрации исходных веществ смещает равновесие в сторону образования продуктов реакции. Увеличение концентрации продуктов реакции смещает равновесие в сторону образования исходных веществ. Степень смещения равновесия при данном количестве реагента находится в зависимости от стехиометрических коэффициентов. В случае равновесной системы
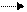 СО + Н2Опар СО2 + Н2
СО + Н2Опар СО2 + Н2
равновесие может быть смещено вправо увеличением концентрации СО или Н2О (водяного пара); уменьшение концентрации СО2 или Н2 также приводит к смещению равновесия вправо. При увеличении концентрации СО2 или Н2, а также при уменьшении концентрации СО или Н2О равновесие смещается влево. Для гетерогенного равновесия изменение концентраций твердых фаз не влияет на сдвиг равновесия.
Влияние изменения давления на смещение химического равновесия. В соответствии с принципом Ле Шателье-Брауна увеличение давления смещает равновесие в сторону той реакции, которая приводит к уменьшению общего числа молекул в газовой смеси, а, следовательно, к уменьшению давления в системе. Наоборот, при уменьшении давления равновесие смещается в сторону реакции, сопровождающейся увеличением общего числа молекул газа, что влечет за собой увеличение давления в системе. Так, уравнение процесса
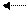
 3Н2 + N2 2NН3
3Н2 + N2 2NН3
показывает, что из одной молекулы азота и трех молекул водорода образуются две молекулы аммиака. Из-за уменьшения числа молекул повышение давления вызывает смещение равновесия реакции вправо – в сторону образования аммиака, что сопровождается понижением давления в системе. Наоборот, понижение давления в системе приводит к смещению равновесия влево – в сторону разложения аммиака, что влечёт за собой повышение давления в системе.
В тех случаях, когда в результате реакции число молекул газообразных веществ остаётся постоянным, при изменении давления одинаково изменяются скорости прямой и обратной реакций, и поэтому равновесие не смещается. К таким реакциям относятся, н-р:



 СО + Н2Опар СО2 + Н2 N2 + O2 2NO
СО + Н2Опар СО2 + Н2 N2 + O2 2NO
Принцип Ле Шателье-Брауна имеет большое практическое значение. Он даёт возможность находить такие условия, которые обеспечивают максимальный выход желаемого вещества. Технология производства важнейших химических продуктов основана на применении принципа Ле Шателье-Брауна и на расчетах, вытекающих из закона действующих масс.
Пример 1. Какие меры можно предпринять для повышения выхода продукта реакции N2 + 3H2 «2NH3, D Н 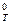 = -92, 4
= -92, 4 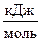 .
.
|
|
